题目内容
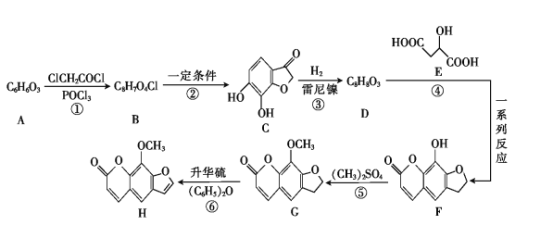
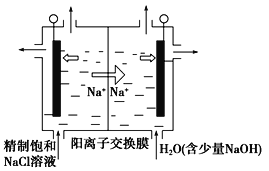
【题目】氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,工作原理如图所示,其中各电极未标出。下列有关说法错误的是( )
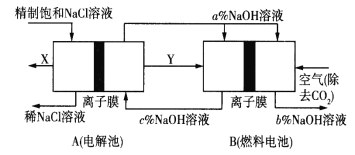
A.A池中右边加入NaOH溶液的目的是增大溶液的导电性
B.两池工作时收集到标准状况下气体X为2.24L,则理论上此时充入标准状况下的空气(不考虑去除CO2的体积变化)的体积约为5.6L
C.A为阳离子交换膜、B为阴离子交换膜
D.氢氧化钠的质量分数从大到小的顺序为b%>a%>c%
【答案】C
【解析】
A.氢氧化钠是强电解质,A池中右边加入NaOH溶液的目的是增大溶液的导电性,A正确;
B.电解池中,阳极反应:2Cl--2e-=Cl2↑,X是氯气,阴极氢离子放电2H++2e-=H2↑,Y是氢气,2.24氯气是0.1molCl2,转移电子是0.2mol,燃料电池中,正极发生得电子的还原反应:O2+2H2O+4e-=4OH-,当转移0.2mol电子,理论上燃料电池中消耗O2的物质的量为0.05mol,标况下体积是0.05mol×22.4L/mol=1.12L,因此此时充入标准状况下的空气(不考虑去除CO2的体积变化)的体积约为1.12L×5=5.6L,B正确;
C.电解池中阳离子向阴极移动,原电池中阳离子向正极移动,则A、B均为阳离子交换膜,C错误;
D.燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即b%大于a%,负极氢气失电子生成氢离子消耗氢氧根离子,所以a%>c%,得到b%>a%>c%,D正确。
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目