题目内容
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
【答案】Al(OH)3 0.01 mol 15mL NaAlO2、NaCl 0.5mol·L-1 Al3++4OH-=![]() +2H2O
+2H2O
【解析】
本题是一道铝盐和碱反应的题目,只需牢牢抓住AlCl3+3NaOH===Al(OH)3↓+3NaCl和Al(OH)3+NaOH===NaAlO2+2H2O两个主要反应来分析即可,OA段沉淀质量在不断增加,因此是第一个反应,AB段沉淀质量开始减少,因此是AB段。
(1)向AlCl3溶液中滴加NaOH溶液时,先发生反应:AlCl3+3NaOH===Al(OH)3↓+3NaCl,后发生反应:Al(OH)3+NaOH===NaAlO2+2H2O,故A点沉淀为Al(OH)3,其物质的量为![]() =0.01 mol;
=0.01 mol;
(2)根据Al3++3OH-===Al(OH)3↓可知,反应至A点时消耗的n(NaOH)=3n[Al(OH)3]=0.01mol×3=0.03mol,消耗NaOH溶液的体积为![]() =0.015 L=15mL;
=0.015 L=15mL;
(3)根据AlCl3+3NaOH===Al(OH)3↓+3NaCl、Al(OH)3+NaOH===NaAlO2+2H2O可知,B点溶液中的溶质为NaAlO2、NaCl;
(4)c(AlCl3)=![]() =0.5 mol·L-1;
=0.5 mol·L-1;
(5)O点到B点总反应为Al3+转化为![]() 反应,总离子方程式为Al3++4OH-===
反应,总离子方程式为Al3++4OH-===![]() +2H2O。
+2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
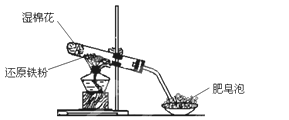
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
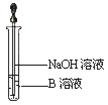
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________