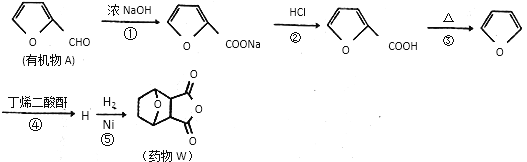
题目内容
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
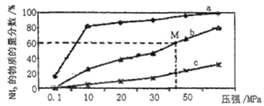
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ·mol-1 7∶4(或1.75∶1) 0.22mol·L-1·min-1 b k正/k逆 200℃ 75% 显碱性,因为Kb(NH3·H2O)>Ka2(H2SO3),所以SO32-水解程度大(或其他合理解释)
【解析】(1)若某反应的平衡常数表达式为:K=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],该反应为2NO(g)+2CO(g)N2(g)+2CO2(g),①N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol③2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol由盖斯定律计算②×2③①得到2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ·mol-1,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ·mol-1
(2)① 2N2O5(g)![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
开始(mol/L) 1.0000
反应(mol/L) 0.5 1 0.25
2min(mol/L) 0.5 10.25
反应前后气体的压强之比等于其物质的量之比,所以p:p0=(0.5+1+0.25)mol:1.00mol=7:4(或1.75),2~5min内用NO2表示的该反应的平均反应速率为v(NO2)=![]() =0.22mol·L-1·min-1②a.NO2和O2的浓度比始终保持不变,不能确定反应是否达到化学平衡状态,故a错误;b.该反应是气体体积增大的反应,容器中的压强不断的发生变化,当容器中压强不再变化,反应已达到化学平衡状态,故b正确;c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;d.在恒容的条件下,该反应 气体的密度始终保持不变,不能确定反应是否达到化学平衡状态,故d错误。答案为:①7∶4(或1.75∶1) 、 0.22mol·L-1·min-1 ②b
=0.22mol·L-1·min-1②a.NO2和O2的浓度比始终保持不变,不能确定反应是否达到化学平衡状态,故a错误;b.该反应是气体体积增大的反应,容器中的压强不断的发生变化,当容器中压强不再变化,反应已达到化学平衡状态,故b正确;c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;d.在恒容的条件下,该反应 气体的密度始终保持不变,不能确定反应是否达到化学平衡状态,故d错误。答案为:①7∶4(或1.75∶1) 、 0.22mol·L-1·min-1 ②b
(3)平衡时正逆反应速率相等,由正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),联立可得Kp= k正/k逆,答案为; k正/k逆
(4) ①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃
②3N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
反应前(mol)1 30
反应了(mol)x3x2x
平衡时(mol)1x33x2x
据题意M点时:![]() =60% x=
=60% x=![]() ,则氢气的转化率为
,则氢气的转化率为![]() 答案为:①200℃②
答案为:①200℃②![]()
(5)铵根离子水解使溶液显酸性,亚硫酸根离子水解使溶液显碱性,铵根离子水解得到氨水,亚硫酸根离子水解得到亚硫酸氢根离子,亚硫酸根离子是H2SO3的第二步电离,由于K(NH3·H2O)>Ka1,说明氨水比亚硫酸氢根离子的电离能力强,根据越弱越水解,铵根离子的水解程度小于亚硫酸根离子的水解程度,故溶液显碱性;答案为:显碱性,因为Kb(NH3·H2O)>Ka2(H2SO3),所以SO32-水解程度大

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案