题目内容
19.已知:I2+2S2O32-═S4O62-+2I-,相关物质的溶度积常数见下表:| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,而是生成Cu(OH)Cl,写出相关的化学反应方程式:CuCl2•2H2O△_△––––––Cu(OH)Cl+HCl↑+H2O.由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥HCl气流中加热制得.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀.过滤后,用0.100 0mol•L-1 Na2S2O3标准溶液滴定所得滤液,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作滴定指示剂,滴定终点的现象是蓝色变为无色,且在半分钟内无变化.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95.0%.
分析 (1)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=KW[Fe(OH)3]C3(OH−)计算c(Fe3+);
(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,根据物质间的关系式进行计算;
解答 解:(1)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,则溶液中的Fe3+转化为Fe(OH)3沉淀,加入物质能与酸反应能转化为氯化铜,且不能引进杂质,可以是Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;
溶液的pH=4,所以溶液中氢氧根离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=KW[Fe(OH)3]C3(OH−)=2.6×10−39(1×10−10)3=2.6×10-9mol/L,
故答案为:Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3;2.6×10-9mol/L;
(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,得到碱式氯化铜,以至于得不到CuCl2,反应方程式为:CuCl2•2H2O△_Cu(OH)Cl+HCl↑+H2O,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解,并带走水蒸气,
故答案为:CuCl2•2H2O△_Cu(OH)Cl+HCl↑+H2O;HCl;
(3)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点时溶液蓝色褪去,且半分钟内不变色,
故答案为:淀粉;蓝色变为无色,且在半分钟内无变化;
②CuCl2溶液与KI反应的离子方程式为为:2Cu2++4I-═2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-═2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0200L 0.002mol 则CuCl2•2H2O的物质的量为:0.002mol,
试样中CuCl2•2H2O的质量百分数为0.002mol/L×171g/mol0.36g×100%=95.0%,
故答案为:95.0%;
点评 本题考查Ksp计算和物质制备,利用平衡移动原理、氧化还原滴定分析解答,明确滴定过程的反应原理和计算方法是解本题的关键,注意加热灼烧CuCl2溶液和CuSO4溶液得到固体的区别,为易错点,题目难度中等.

| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 |
| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
| A. | 加热 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |
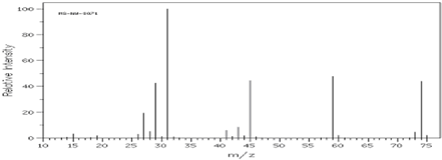
| A. | 74 | B. | 31 | C. | 59 | D. | 45 |
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低.
| A. | ①②③ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①② |
| A. | 因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼 | |
| B. | H2O(g)→H2O(l)的过程放出大量的热,所以该过程是化学变化 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 1 mol/L的稀H2SO4溶液与1 mol/L的稀Ba(OH)2溶液完全反应所放出的热量就是该反应的中和热 |
| A. |  | B. |  | C. |  | D. | CH3Cl |
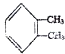 ;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为
;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为 或
或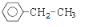 .
.