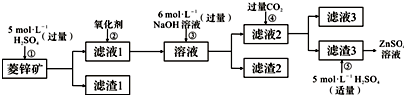
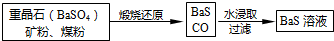
题目内容
14.常温下,石灰乳悬浊液中存在如下平衡:Ca(OH)2(s)═Ca2+(aq)+2OH-(ag),下列外界条件改变,石灰乳悬浊液中pH仍保持不变的是( )(不考虑固体与水热效应)| A. | 加热 | B. | 加入少量CaO(s) | C. | 加入少量NaOH(s) | D. | 加入少量CaCl2(s) |
分析 A.氢氧化钙溶解度随温度的升高而降低,析出固体后仍为饱和溶液;
B.向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,消耗水,溶液中c(Ca2+)、c(OH-)增大;
C.根据氢氧化钠溶于水电离出OH-,KW=c(H+).c(OH-),pH=-lg[c(H+)]分析;
D.加入少量CaCl2(s),c(Ca2+)增大,平衡左移,根据pH=-lg[c(H+)]分析;
解答 解:A.加热石灰乳悬浊液,则沉淀溶解平衡向逆反应方向移动,故各离子的数目减少,但析出固体后仍为饱和溶液,c(OH-)不变,pH仍保持不变,故A正确;
B.加入CaO,发生:CaO+H2O=Ca(OH)2,消耗水,溶液中c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则沉淀溶解平衡向逆反应方向移动,故各离子的数目减少,但是饱和溶液的浓度只与温度有关,故浓度保持不变,pH仍保持不变,故B正确;
C.加入NaOH固体,在溶液中电离出OH-,平衡向逆方向移动,但OH- 浓度总体增大,KW=c(H+).c(OH-),c(H+)减小,pH增大,故C错误;
D.加入CaCl2固体,Ca2+浓度增大,则平衡向逆方向移动,Ca(OH)2增大,c(OH-)减小,c(H+)增大,pH减小,故D错误;
故选AB.
点评 本题考查难溶电解质的溶解平衡,注意掌握溶液酸碱性与溶液pH的关系以及从平衡移动的角度分析是解答关键,题目难度不大.

练习册系列答案
相关题目
2.下列有关实验的说法正确的是( )
| A. | CH2=CH-CHO能使酸性高锰酸钾溶液褪色,证明该分子中一定含有碳碳双键 | |
| B. | 现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O?2CrO42-+2H+ | |
| C. | 用相互滴加的方法不能鉴别NaCl、AlCl3、Na2CO3、NaHSO4四种无色溶液 | |
| D. | SO2通入Ba(NO3)2溶液中出现白色沉淀,证明BaSO3不溶于水 |
9.下列各轨道按能量由低到高顺序排列,不正确的是( )
| A. | 4s 3d 5s | B. | 5s 4d 5p | C. | 3px3d4s | D. | 3d 4p 4f |
19.已知:I2+2S2O32-═S4O62-+2I-,相关物质的溶度积常数见下表:
(1)常温下,某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,而是生成Cu(OH)Cl,写出相关的化学反应方程式:CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)Cl+HCl↑+H2O.由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥HCl气流中加热制得.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀.过滤后,用0.100 0mol•L-1 Na2S2O3标准溶液滴定所得滤液,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作滴定指示剂,滴定终点的现象是蓝色变为无色,且在半分钟内无变化.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95.0%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,而是生成Cu(OH)Cl,写出相关的化学反应方程式:CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)Cl+HCl↑+H2O.由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥HCl气流中加热制得.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀.过滤后,用0.100 0mol•L-1 Na2S2O3标准溶液滴定所得滤液,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉作滴定指示剂,滴定终点的现象是蓝色变为无色,且在半分钟内无变化.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95.0%.
6.同周期的X.Y.Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由大到小 |
3.李克强总理在全国人大会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是( )
| A. | 用“绿色化学”工艺,使原料完全转化为目标产物 | |
| B. | 开发新能源,减少化石能源的使用,减少污染 | |
| C. | 开发新型电池,推广废旧电池的回收、处理经验 | |
| D. | 大量使用农药化肥,减少病虫害,提高粮食产量 |
4.下列有关说法中,错误的是( )
| A. | 浓硫酸置于敞口容器中,溶液质量会增加 | |
| B. | 处理散落在地面上的汞的方法是撒上硫粉 | |
| C. | 干燥氨气既可用碱性干燥剂,碱石灰,也可用中性干燥剂,如:无水氯化钙 | |
| D. | 常温下,Fe与浓硫酸,不可能有氢气生成 |