题目内容
8.下列说法正确的是( )| A. | 室温下,CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| B. | 相同温度下,0.6 mol•L-1氨水和0.3 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 向0.1 mol•L-1NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO3-) | |
| D. | 室温下,0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):则c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
分析 A.根据混合液中的物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH)、2c(Ca2+)=c(Cl-)判断;
B.氨水浓度越大,一水合氨的电离程度越小;
C.钠离子和硝酸根离子不发生反应,根据物料守恒可得:c(Na+)=c(NO3-);
D.混合液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O).
解答 解:A.由物料守恒可知:c(Na+)=c(CH3COO-)+c(CH3COOH),2c(Ca2+)=c(Cl-),则c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故A错误;
B.相同温度下,由于0.6 mol•L-1氨水的电离程度比0.3 mol•L-1氨水的电离程度小,则两溶液中c(OH-)之比小于2:1,故B错误;
C.向0.1 mol•L-1NaNO3溶液中滴加盐酸使溶液的pH=5,由于钠离子和硝酸根离子不水解,根据物料守恒可知:c(Na+)=c(NO3-),故C正确;
D.室温下,0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7),混合液呈碱性,则一水合氨的电离程度大于铵根离子的水解程度,故c(NH4+)>c(NH3•H2O),结合物料守恒可知:c(NH4+)>c(Cl-)>c(NH3•H2O),溶液中正确的粒子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理等知识在判断离子浓度大小中的应用方法.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
19.对下列事故预防或处理方法正确的是( )
| A. | 钠、钾着火时用水灭火 | |
| B. | 点燃氢气前要验纯,点燃甲烷前不必验纯 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上浓硫酸 | |
| D. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 |
3.环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
(1)650℃时,若在此容器中开始充入2molH2O(g)、lmolCO、1molCO2和2molH2,则反应在开始时正向进行(填“正向”或“逆向”).
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
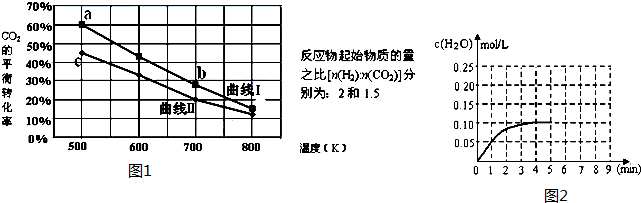
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点
(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点

(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
17.设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 7.8gNa2O2和 Na2S混合物中所含阴离子的数目为0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2LSO2中含有分子的数目为0.5NA | |
| D. | t℃,MgCO3的Kap=4×14-4,则饱和饱和溶液中含Mg2+数目为2×10-3NA |
18.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中发生还原反应与发生氧化反应的氮原子数之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
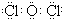 .
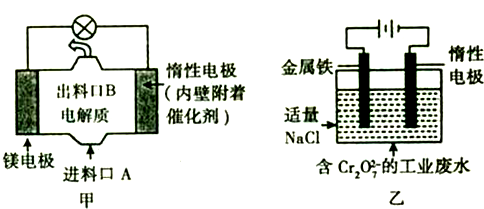
.

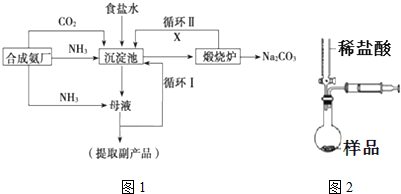
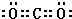 ,沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl.
,沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O═NaHCO3↓+NH4Cl.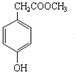 的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.
的分子式是C9H10O3,1mol化合物I完全燃烧,消耗10mol氧气.