题目内容
18.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中发生还原反应与发生氧化反应的氮原子数之比为( )| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
分析 在5NH4NO3=2HNO3+4N2+9H2O的反应中,NH4+→N2,N元素的化合价由-3价→0价,NO3-→N2,N元素的化合价由+5价→0价,从化合价变化的角度判断氧化剂和还原剂,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等判断发生还原反应与发生氧化反应的氮原子数之比.
解答 解:在5NH4NO3=2HNO3+4N2+9H2O的反应中,NH4+→N2,N元素的化合价由-3价→0价,-3价的N元素被氧化,化合价升高3价,NO3-→N2,N元素的化合价由+5价→0价,+5价的N元素化合价降低,被还原,化合价降低5价,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等可知,发生还原反应与发生氧化反应的氮原子数之比是3:5,故选D.
点评 本题考查氧化还原反应的计算,题目难度不大,本题注意根据方程式判断元素的化合价的变化,判断N元素化合价的变化为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法正确的是( )
| A. | 室温下,CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| B. | 相同温度下,0.6 mol•L-1氨水和0.3 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 向0.1 mol•L-1NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO3-) | |
| D. | 室温下,0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):则c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
9.关于Na2CO3和NaHCO3性质的说法正确的是( )
| A. | 25℃时,在水中的溶解度NaHCO3大于Na2CO3 | |
| B. | 用Ba(OH)2溶液能鉴别碳酸钠和碳酸氢钠溶液 | |
| C. | 受热时,NaHCO3比Na2CO3容易分解 | |
| D. | NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同 |
6.下列关于钠及其化合物的叙述正确的是( )
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | Na和Na+的化学性质相似 | |
| C. | 实验室通常把钠保存在石蜡油或煤油中 | |
| D. | 在相同温度下,Na2CO3比NaHCO3在水中的溶解度小 |
13.对下列事故预防或处理方法正确的是( )
| A. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 | |
| B. | 欲配置500 mL l mol/LNaOH溶液,应将20gNaOH固体溶于500 mL水中 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硫酸 | |
| D. | 钠着火时用二氧化碳灭火 |
3.下面有关丙烷、丙烯、丙炔说法中正确的是( )
| A. | 如图,丙烷、丙烯、丙炔的结构分别表示为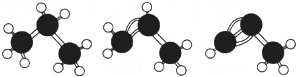 | |
| B. | 相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3:2:1 | |
| C. | 丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相同条件下密度逐渐增大 | |
| D. | 丙炔的碳原予空间结构呈线性排列 |
7.下列分子式表示的有机物可能是混合物的是( )
| A. | C6H6 | B. | C2H6 | C. | C3H8 | D. | C2H5Cl |
8.下列各组物质中,所含分子数相同的是(NA表示阿伏加德罗常数)( )
| A. | 1 molH2和16gO2 | B. | NA个N2和11gCO2 | ||
| C. | 18gH2O和1molBr2 | D. | 22.4 LH2(标准状况)和0.1NACO2 |

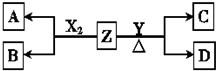 短周期元素组成的单质X2,Y.常温下,X2是一种黄绿色气体,Y为淡黄色固体,Z是一种常见的碱,焰色反应呈浅紫色(透过钴玻璃)且0.1mol•L-1 Z的水溶液pH=13.X2、Y 和Z之间有如图转化关系(其他无关物质已略去)
短周期元素组成的单质X2,Y.常温下,X2是一种黄绿色气体,Y为淡黄色固体,Z是一种常见的碱,焰色反应呈浅紫色(透过钴玻璃)且0.1mol•L-1 Z的水溶液pH=13.X2、Y 和Z之间有如图转化关系(其他无关物质已略去)