题目内容
16.ZnSe是一种光电性能优异的半导体材料,某研究小组用如图1方法制备了ZnSe.
(1)SeO2溶于水生成H2SeO3,下列物质与水反应,跟此反应类型相同的是bc
a.NO2 b.SO2 c.CaO d.Na2O2 e.F2
(2)硒酸(H2SeO4)的水溶液按下式发生一级和二级电离:H2SeO4=H++HSeO4-;HSeO4-?H++SeO42-,K2=1.0×10-2(298K)
①NaHSeO4溶液显酸性(填“酸性”、“中性”、“碱性”).
②向H2SeO4溶液中滴加少量氨水,该反应的离子方程式为H++NH3•H2O=NH4++H2O.
③已知H2CO3的两级电离常数分别为Kl=4.2×10-7,K2=5.6×10-11,则KHCO3和KHSeO4两溶液混合后反应的离子方程式为HCO3-+HSeO4-=CO2↑+SeO42-+H2O.
(3)肼(N2H4)与SeO32-反应的氧化产物是N2.氧化剂与还原剂的物质的量之比为2:3.
(4)电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的负极,乙池中电极反应式为2NO3-+12H++10e-=6H2O+N2↑,为使反应持续进行,须适时向甲池中添加H2O.
分析 (1)SeO2溶于水生成H2SeO3,是化合反应,而a.NO2与水反应不是化合反应; b.SO2与水反应生成亚硫酸是化合反应;c.CaO与水反应生成氢氧化钙是化合反应; d.Na2O2与水反应生成氢氧化钠和氧气不是化合反应; e.F2与水反应生成氢氟酸和氧气非化合反应;
(2)①因为K2=1.0×10-2(298K),所以二步电离程度非常大,所以电离为主溶液呈酸性;
②氨水少量所以第一步完全电离产生的氢离子,还过量;
③已知HSeO4-?H++SeO42-,K2=1.0×10-2(298K)大于H2CO3的一级电离常数分别为Kl=4.2×10-7,所以KHCO3和KHSeO4两溶液混合,强酸制弱酸;
(3)在反应釜中反应物有Zn2+、SeO32-、N2H4,生成物有N2,根据氧化还原反应得失电子相等和质量守恒定律书写离子方程,然后得出氧化剂与还原剂的物质的量之比;
(4)硝酸根离子由+5价变成0价得电子,发生还原反应,作为阴极,所以直流电源B为负极,阴极的电极反应式为:2NO3-+12H++10e-=6H2O+N2↑,甲池是水电离出的氢氧根离子在阳极发生氧化反应,而氢离子转移到乙池中,即随放电的进行水的量在减少.
解答 解:(1)SeO2溶于水生成H2SeO3,反应方程式为SeO2+H2O═H2SeO3,是化合反应,而a.NO2与水反应不是化合反应,故不选; b.SO2与水反应生成亚硫酸是化合反应,故选;c.CaO与水反应生成氢氧化钙是化合反应,故选; d.Na2O2与水反应生成氢氧化钠和氧气不是化合反应,故不选; e.F2与水反应生成氢氟酸和氧气非化合反应,故不选;故选:b c;
(2)①因为K2=1.0×10-2(298K),所以二步电离程度非常大,所以电离溶液呈酸性,故答案为:酸性;
②氨水少量所以第一步完全电离产生的氢离子,还过量,所以反应的离子方程式为:H++NH3•H2O=NH4++H2O,故答案为:H++NH3•H2O=NH4++H2O;
③已知HSeO4-?H++SeO42-,K2=1.0×10-2(298K)大于H2CO3的一级电离常数分别为Kl=4.2×10-7,所以KHCO3和KHSeO4两溶液混合,强酸制弱酸,所以反应方程式为:HCO3-+HSeO4-=CO2↑+SeO42-+H2O,故答案为:HCO3-+HSeO4-=CO2↑+SeO42-+H2O;
(3)在反应釜中反应物有Zn2+、SeO32-、N2H4,生成物有N2,SeO32-被还原为-2价的Se,与Zn2+生成ZnSe,根据氧化还原反应得失电子相等和质量守恒定律,离子方程式为2Zn2++2SeO32-+3N2H4=2ZnSe+3N2↑+6H2O,所以氧化剂SeO32-和还原剂N2H4的物质的量之比为2:3,故答案为:2:3;
(4)硝酸根离子由+5价变成0价得电子,发生还原反应,作为阴极,所以直流电源B为负极,阴极的电极反应式为:2NO3-+12H++10e-=6H2O+N2↑,甲池是水电离出的氢氧根离子在阳极发生氧化反应,而氢离子转移到乙池中,所以要在甲池中加H2O,故答案为:负;2NO3-+12H++10e-=6H2O+N2↑;H2O.
点评 本题考查较为综合,涉及氧化还原反应、电化学等知识,本题难度中等,本题易错点为(3),注意判断反应物和生成物,用守恒的方法书写离子方程式.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 盐酸和氨水反应 H++OH-=H2O | |
| B. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气和氢氧化钠溶液反应 Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 铜和稀硝酸反应 Cu+2NO3-+4H+=2Cu2++2NO2↑+2H2O |
| A. | 铁红常用作红色油漆和涂料 | |
| B. | 明矾可用作净水剂 | |
| C. | 氯气可用于制造漂白粉 | |
| D. | 氧化钠常用作呼吸面具中氧气的来源 |
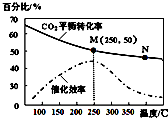
| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
| A. | 室温下,CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| B. | 相同温度下,0.6 mol•L-1氨水和0.3 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 向0.1 mol•L-1NaNO3溶液中滴加盐酸使溶液的pH=5,此时混合液中的c(Na+)=c(NO3-) | |
| D. | 室温下,0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):则c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径::Na+>O2->F- | |
| C. | 稳定性::HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | Na和Na+的化学性质相似 | |
| C. | 实验室通常把钠保存在石蜡油或煤油中 | |
| D. | 在相同温度下,Na2CO3比NaHCO3在水中的溶解度小 |
 互为同系物且一氯代物只有两种的物质的结构简式:
互为同系物且一氯代物只有两种的物质的结构简式: 或
或 .
.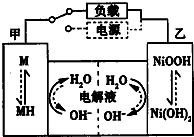 近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.