题目内容
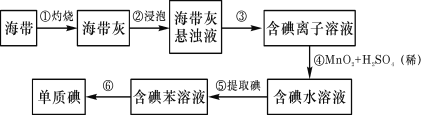
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)毒重石用盐酸浸取前需充分研磨,目的是________。
(2)实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________________。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(3)加入NH3·H2O调pH=8可除去________________(填离子符号),滤渣Ⅱ中含________________(填化学式)。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+![]() Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
①BaCl2溶液的浓度为________________mol·L-1。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将____________(填“偏大”或“偏小”)。
【答案】增大接触面积从而使反应速率增大,同时提高浸出率 AC Fe3+ Mg(OH)2、Ca(OH)2 ![]() 偏大
偏大
【解析】
制备BaCl22H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl22H2O。
(1)研磨将块状固体变成粉末状,这样可以增大反应物的接触面积,从而可增大反应速率;
(2)实验室用37%的盐酸配制15%的盐酸,根据溶液中质量分数= ×100%,结合溶液中稀释的过程中溶质的质量不变计算出浓盐酸的体积和水的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器应选择A;同时使用玻璃棒搅拌加速溶解应选择C,故使用仪器的合理选项是AC;
×100%,结合溶液中稀释的过程中溶质的质量不变计算出浓盐酸的体积和水的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器应选择A;同时使用玻璃棒搅拌加速溶解应选择C,故使用仪器的合理选项是AC;
(3)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;
(4)①向x mL一定浓度的Na2CrO4溶液加入盐酸的总物质的量n(HCl)=V0×10-3×b mol,移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL,则发生反应2CrO42-+2H+![]() Cr2O72-+2H2O消耗CrO42-的物质的量n(CrO42-)=n(HCl)=V1×10-3×b mol,发生反应Ba2++CrO42-=BaCrO4↓消耗的CrO42-物质的量n(CrO42-)=V0×10-3×b mol-V1×10-3×b mol=(V0-V1)×10-3×b mol,由于步骤Ⅱ是移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度c(BaCl2)=
Cr2O72-+2H2O消耗CrO42-的物质的量n(CrO42-)=n(HCl)=V1×10-3×b mol,发生反应Ba2++CrO42-=BaCrO4↓消耗的CrO42-物质的量n(CrO42-)=V0×10-3×b mol-V1×10-3×b mol=(V0-V1)×10-3×b mol,由于步骤Ⅱ是移取y mLBaCl2溶液于锥形瓶中,所以BaCl2溶液的浓度c(BaCl2)=![]() =
=![]() mol/L。
mol/L。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则发生反应2CrO42-+2H+![]() Cr2O72-+2H2O的CrO42-的物质的量减小,发生Ba2++CrO42-=BaCrO4↓的CrO42-的物质的量偏大,导致Ba2+浓度测量值将偏大。
Cr2O72-+2H2O的CrO42-的物质的量减小,发生Ba2++CrO42-=BaCrO4↓的CrO42-的物质的量偏大,导致Ba2+浓度测量值将偏大。