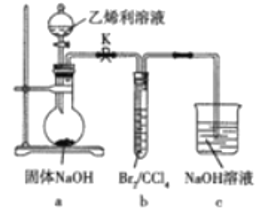
题目内容
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
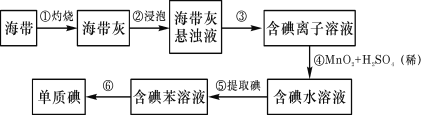
请填写下列空白:
(1)从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是____
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧
A.海带灼烧灰化,选用①②⑧ B.加水浸泡加热,选用②④⑦
C.过滤得到滤液,选用④⑤⑦ D.萃取和分液,选用③④⑥
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是_____。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小于水
c.碘在苯中溶解度大于水 d.苯与水互不相溶
提取碘的过程中,不能使用的有机溶剂是__________。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(3)步骤④中MnO2的作用是__________(选填:氧化剂、还原剂、催化剂)。
(4)单质碘有许多用途,其中之一是生产加碘食盐中的碘剂——碘酸钾(KIO3)。合格加碘食盐含碘量(以I计)为20-50mg/Kg,则每千克该加碘食盐中碘酸钾的最小质量为_____ mg。
(5)已知:2Fe3++2I-=2Fe2++I2 氯气既可以氧化Fe2+,也可以氧化I-。往200mLFeI2溶液中通入8.96L(标准状况)Cl2,反应完成后,溶液中有![]() Fe2+被氧化,则原FeI2溶液的物质的量浓度_______。
Fe2+被氧化,则原FeI2溶液的物质的量浓度_______。
【答案】D acd a 氧化剂 33.7 1.6
【解析】
灼烧海带将海带中的有机物转化为无机物,海带灰溶解过滤后得到含碘离子的溶液,在酸性条件下,二氧化锰与碘离子发生氧化还原反应得到碘单质,再加入苯进行萃取分液,最后蒸馏得到碘单质。
(1)A.海带灼烧灰化,需要选用①坩埚、②酒精灯、⑧泥三角,A不符合题意;
B.加水浸泡加热,需要选用②酒精灯、④烧杯、⑦玻璃棒,B不符合题意;
C.过滤得到滤液,需要选用④烧杯、⑤漏斗、⑦玻璃棒,C不符合题意;
D.萃取和分液,需要选用④烧杯、⑥分液漏斗,而③试管不是必需的,D符合题意。
答案选D。
(2)萃取剂的选择必须满足:不与萃取物发生反应;萃取物在其溶解度大;与原溶剂不互溶;故选择用苯来提取碘水中的单质碘的理由是选acd。而酒精与水互溶不能选作萃取剂;
(3)步骤④中MnO2与碘离子发生氧化还原反应2I-+MnO2+4H+═Mn2++I2+2H2O生成碘单质,MnO2中的Mn化合价降低,作用为氧化剂;
(4)1kg食盐中至少含碘元素20mg,即含Ⅰ物质的量为![]() ,故每千克食盐中n(KIO3)=n(I)=1.57×10-4mol,质量为
,故每千克食盐中n(KIO3)=n(I)=1.57×10-4mol,质量为![]() ;
;
(5)已知还原性强弱:I->Fe2+。往200mL碘化亚铁溶液中缓慢通入8.96L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为![]() ,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有
,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有![]() 的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+。设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2cmol/L,c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为n(Cl2)=
的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+。设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2cmol/L,c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为n(Cl2)=![]() n(I-)=
n(I-)=![]() ,反应完成后溶液中有
,反应完成后溶液中有![]() 的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=
的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=![]() ×
×![]() n(Fe2+)=
n(Fe2+)=![]() c×0.2L=0.05cmol,所以0.05cmol+0.2cmol=0.4mol,解得:c=1.6mol/L。
c×0.2L=0.05cmol,所以0.05cmol+0.2cmol=0.4mol,解得:c=1.6mol/L。

【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)毒重石用盐酸浸取前需充分研磨,目的是________。
(2)实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________________。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(3)加入NH3·H2O调pH=8可除去________________(填离子符号),滤渣Ⅱ中含________________(填化学式)。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+![]() Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
①BaCl2溶液的浓度为________________mol·L-1。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将____________(填“偏大”或“偏小”)。