题目内容
【题目】一定温度下,一密闭容器中有如下反应:4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g),下列叙述中不能说明该反应一定达到了平衡状态的是
N2(g)+4CO2(g),下列叙述中不能说明该反应一定达到了平衡状态的是
A.单位时间内有amolCO参加反应,同时也有amolCO2参加反应
B.NO2的生成速率:N2的消耗速率=2:1
C.CO的消耗速率:NO2的生成速率=2:1
D.NO2的消耗速率:CO2的消耗速率=1:2
【答案】B
【解析】
A.单位时间内有amolCO参加反应,同时也有amolCO2参加反应,说明正逆反应速率相等,达到了平衡状态,故A不选;
B.NO2的生成是逆反应方向,N2的消耗也是逆反应方向,不能说明该反应到达平衡状态,故B选;
C.CO的消耗速率和NO2的生成速率之比是2:1,说明正逆反应速率相等,反应达到平衡状态,故C不选;
D.NO2的消耗速率和CO2的消耗速率之比是1:2,说明正逆反应速率相等,反应达到平衡状态,故D不选;
故选B。

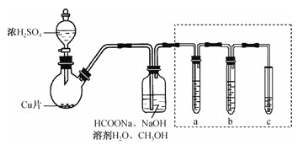
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)毒重石用盐酸浸取前需充分研磨,目的是________。
(2)实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________________。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(3)加入NH3·H2O调pH=8可除去________________(填离子符号),滤渣Ⅱ中含________________(填化学式)。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+![]() Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
①BaCl2溶液的浓度为________________mol·L-1。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将____________(填“偏大”或“偏小”)。
【题目】甲醇是一种重要的化工原料.
![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______span>
______span>
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
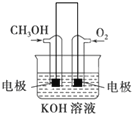
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次;
B.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.调节液面至“0”或“0”以下刻度,记下读数;
E.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的现象是______________________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度