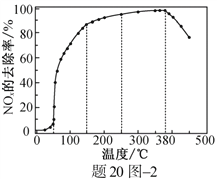
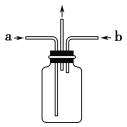
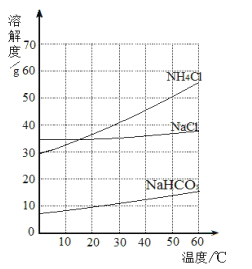
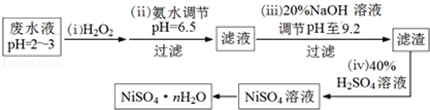
��Ŀ����
����Ŀ����ѡ������ʵ�鷽���������ʣ������뷽����������ں����ϡ�
A����ȡ��Һ�� B�����ȷֽ� C���ᾧ�� D����Һ�� E�������� F������ G�����˷�
(1)___________����ˮ��ú�͵Ļ���
(2)___________����ˮ�;ƾ���
(3)___________������ˮ�е����ˮ��
������98%��Ũ����(g��1.84g/cm3)����Ũ��Ϊ0.5mol/L��ϡ����480ml���ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� �ܽ�ͷ�ι� ����Ͳ ��������ƽ��ҩ�ס�
��ش��������⣺
(4)���������У�������ϡH2SO4ʱ����Ҫʹ�õ���___________(�����)����ȱ�ٵ�������______________________��
(5)�����㣬��ŨH2SO4�����Ϊ___________�����ʵ������15mL��20mL��50mL����ͲӦѡ��_______mL����Ͳ��ã���ȡʱ������Ͳ������ʹŨ��__________(��ƫ�ߡ�����ƫ�͡�������Ӱ�족)��
(6)��Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ����Ŀ����____________����δ��ȴ�����±㽫��Һת��������ƿ��ʹŨ��ƫ________��
���𰸡�D F A �ڢޢ� 500ml����ƿ 13.6ml 15 ƫ�� Ѹ��ɢ�ȷ�ֹ���� ��
��������
I.(1)ˮ��ú���ǻ������ݵ�����Һ�����ʣ����÷�Һ�������룬�ʺ���ѡ����D��
(2)�ƾ���ˮ�ǻ��ܣ����е㲻ͬ��Һ�����ѡ�������룬�ʺ���ѡ����F��
(3)�岻������ˮ���������л��ܼ�����ѡ����ȡ��Һ�����룬�ʺ���ѡ����A��
II.(4) ���Ʋ�������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡŨ������Һ���ձ���ϡ�ͣ���ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ�������в���������Ͳ����ͷ�ιܡ�С�ձ���500ml����ƿ�������ò�������������ƿ��������ƽ��ҩ�ף��ʺ���ѡ���Ǣڢޢߣ�û�й����480mL������ƿ������ѡ�������� �����������ԭ��Ӧ��ѡ��500mL����ƿ������ȱ��500mL����ƿ��
(5) 98%��Ũ��������ʵ���Ũ��c=![]() ����Һ��ϡ��ǰ�����ʵ����ʵ������䣬����18.4mol/L��V=0.5mol/L��500mL�����V=13.6mL��ѡ���������������ȡҺ������Խ�ӽ������ԽС���������Ҫ��ȡ13.6mLŨ���ᣬӦ��ѡ��15mL����Ͳ����ȡʱ������Ͳ��������ȡ��Һ��ƫ�٣���c=
����Һ��ϡ��ǰ�����ʵ����ʵ������䣬����18.4mol/L��V=0.5mol/L��500mL�����V=13.6mL��ѡ���������������ȡҺ������Խ�ӽ������ԽС���������Ҫ��ȡ13.6mLŨ���ᣬӦ��ѡ��15mL����Ͳ����ȡʱ������Ͳ��������ȡ��Һ��ƫ�٣���c=![]() ��֪��ʹŨ��ƫ�ͣ�
��֪��ʹŨ��ƫ�ͣ�
(6)Ũ��������ˮ��ų��������ȣ�ʹ��Һ���¶����ߣ���Ũ�������ձ��ڱ�����ע��ʢˮ���ձ��У����ò��������Ͻ����Ŀ����Ѹ��ɢ�ȷ�ֹ���У���δ��ȴ�����±㽫��Һת��������ƿ�����ݺ����Һ�ָ������£�Һ�岻���̶��ߣ����ʹŨ��ƫ�ߡ�

����Ŀ��ij��ɫϡ��ҺX�У����ܺ���������������е�ij���֡�
������ | CO |
������ | Al3����Fe3����Mg2����NH |
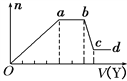
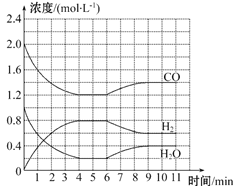
ȡ����Һ�����������м���ij�Լ�Y���������������ʵ���(n)������Լ����(V)�Ĺ�ϵ��ͼ��ʾ��
��1����Y�����ᣬ����Һ�к��е���������______ ��ab�η�����Ӧ�������ӷ���ʽΪ____________, Oa���ϱ��вμӷ�Ӧ�����ӵ����ʵ���֮��Ϊ________________________��
[Ҫ�������ӷ��ţ���n��Fe3+��]��
��2����Y��NaOH��Һ����X��һ�������ϱ��е�������________________________�����ǵ����Ӹ�����Ϊ______________________________��[����������ǰ���������ں���ǰ���ͼ��ں��˳������]��ab�η�Ӧ�����ӷ���ʽΪ______________________________�� bc�η�Ӧ�����ӷ���ʽΪ____________________________________��