题目内容
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为___________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为_____________。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属_____________分子(选填“极性”“非极性”),其立体构型为_____________。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于_____________晶体。
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,分子内的作用力不可能含有_____________(填序号)。
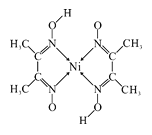
A离子键 B共价键 C金属键 D配位键 E氢键
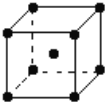
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的摩尔质量为M g/mol,钨原子的半径为a pm。则钨的密度为ρ=_____________g·cm-3。(只需列出计算式,不需化简)
【答案】 [Ar]3d74s2 sp2 极性 平面三角形 分子 AC 2M×1030/ [NA(4a/ √ 3)3]
【解析】试题分析:本题以新型钨钴合金催化剂为题材,主要考查原子核外电子排布、中心原子杂化、分子极性、分子立体构型、晶体性质与分类、分子间作用力、化学键、晶体结构等知识点,重点考查考生对物质结构知识的综合运用能力和晶体结构的简单计算能力。
解析:(1)钴是27号元素,核外电子排布式为1s22s22p63s23p63d74s2。石墨烯中的每个碳原子形成一个C=C键和2个C—C键,所以石墨烯中碳原子杂化方式为sp2。正确答案:1s22s22p63s23p63d74s2(或[Ar]3d74s2)、sp2。(2)甲醛分子中C原子采用sp2杂化,分子呈平面三角形,键角1200(![]() ),是一种极性分子。正确答案:极性、平面三角形。(3)羰基钴熔点低,可溶于多数有机溶剂,所以属于分子晶体。正确答案:分子。(4)该化合物分子中存在C—C(也可以列举其它)共价键、N→Ni配位键、H—O键的H原子与临近N—O键的O原子间形成的氢键。正确答案:AC。(5)晶胞中含有2个钨原子,总质量为
),是一种极性分子。正确答案:极性、平面三角形。(3)羰基钴熔点低,可溶于多数有机溶剂,所以属于分子晶体。正确答案:分子。(4)该化合物分子中存在C—C(也可以列举其它)共价键、N→Ni配位键、H—O键的H原子与临近N—O键的O原子间形成的氢键。正确答案:AC。(5)晶胞中含有2个钨原子,总质量为![]() 。钨晶体晶胞属于体心立方,立方体对角线长4a pm,因此晶胞边长为
。钨晶体晶胞属于体心立方,立方体对角线长4a pm,因此晶胞边长为![]() ,
, 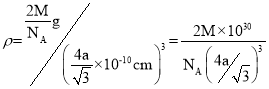 。正确答案:
。正确答案: 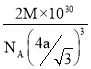 。
。

 阅读快车系列答案
阅读快车系列答案