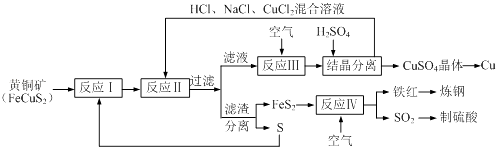
题目内容
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
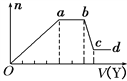
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的阳离子是______ ,ab段发生反应的总离子方程式为____________, Oa段上表中参加反应的离子的物质的量之比为________________________。
[要标明离子符号,如n(Fe3+)].
(2)若Y是NaOH溶液,则X中一定含有上表中的离子是________________________,它们的离子个数比为______________________________,[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].ab段反应的离子方程式为______________________________, bc段反应的离子方程式为____________________________________。
【答案】 Na+ 2H++CO32—=H2O+CO2↑ n(AlO2—)∶n(SiO32—)=2∶11 Al3+、Mg2+、NH4+、Cl- 2:1:4:12 NH4++OH-=NH3·H2O Al(OH)3+OH-=AlO2-+2H2O
【解析】试题分析:溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,当a-b段时,沉淀的量不变化,盐酸和碳酸根离子反应生成气体说明溶液中含有CO32—,则溶液中不含镁离子、铝离子;当b-c段时沉淀的质量减少,部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明溶液中有硅酸根离子和偏铝酸根离子,弱酸根离子和铵根离子能双水解,所以溶液中含有的阳离子是钠离子;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,则a-b段的反应是氢氧化钠和铵根离子反应生成气体; b-c段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中一定有铝离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和偏铝酸根离子,所以溶液中含有的阴离子是氯离子.
解析:根据以上分析,溶液中含有的阳离子是钠离子,ab段发生反应是碳酸根离子和氢离子反应生成二氧化碳和水,离子方程式为:CO32-+2H+=H2O+CO2↑;根据图象知,氢氧化铝和盐酸反应需要1v盐酸,偏铝酸根离子和硅酸根离子和盐酸反应需要4V盐酸,有关反应方程式为:AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3↓、Al(OH)3+3H+=Al3++3H2O,根据方程式知,与AlO2-生成Al(OH)3需要盐酸的体积为![]() ,SiO32-生成H2SiO3需要盐酸的体积是
,SiO32-生成H2SiO3需要盐酸的体积是![]() ,AlO2-、SiO32-生成沉淀需要的盐酸体积比是1:11,n(AlO2—)∶n(SiO32—)=2∶11;
,AlO2-、SiO32-生成沉淀需要的盐酸体积比是1:11,n(AlO2—)∶n(SiO32—)=2∶11;
(2)Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,则a-b段的反应是氢氧化钠和铵根离子反应生成气体;当b-c段时沉淀的质量减少,所以b-c段是氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O,部分沉淀不反应,说明溶液中一定有铝离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和偏铝酸根离子,根据电荷守恒,溶液中含有的阴离子是氯离子;o-a段的反应是铝离子和镁离子与氢氧化钠反应生成氢氧化铝和氢氧化镁沉淀。铵根离子需要氢氧化钠的体积是2v,氢氧化铝和氢氧化钠反应需要氢氧化钠的体积是1v,则生成氢氧化铝需要氢氧化钠的体积是3V,生成氢氧化镁需要氢氧化钠的体积是4v-3v=1V,则n(Al3+):n(Mg2+):n(NH4+)=1:![]() :2=2:1:4,根据溶液中阴阳离子所带电荷相等知,n(Al3+):n(Mg2+):n(NH4+)、n(Cl-)=2:1:4:12,即N(Al3+):N(Mg2+):N(NH4+)、N(Cl-)=2:1:4:12;a-b段的反应是氢氧化钠和铵根离子反应生成氨气,离子方程式是NH4++OH-=NH3·H2O;b-c段是氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O。
:2=2:1:4,根据溶液中阴阳离子所带电荷相等知,n(Al3+):n(Mg2+):n(NH4+)、n(Cl-)=2:1:4:12,即N(Al3+):N(Mg2+):N(NH4+)、N(Cl-)=2:1:4:12;a-b段的反应是氢氧化钠和铵根离子反应生成氨气,离子方程式是NH4++OH-=NH3·H2O;b-c段是氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应离子方程式是Al(OH)3+OH-=AlO2-+2H2O。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是,X的气态氢化物的电子式是 .
(2)Z元素在周期表中的位置是第周期,第族.Z和W形成的化合物属于化合物(填“离子”或“共价”).
(3)X、Y、Z、W的原子半径从大到小的顺序是 .
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: .
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: .
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: .
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为 .
(2)H2SO4与HClO4中,酸性较强的是 .
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是 , 它常用作治疗胃酸(含盐酸)过多的药物,该反应的化学方程式为 .
(4)碳元素形成的一种氧化物的化学式是 , 该物质中C元素与O元素的质量比为 . (相对原子质量:C﹣12 O﹣16)