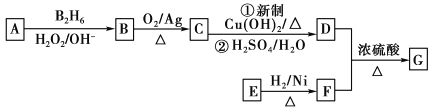
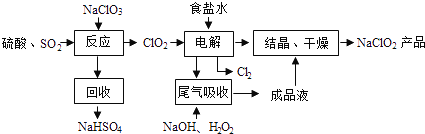
题目内容
【题目】工业上用净化后的水煤气在催化剂作用下,与水蒸气发生反应制取氢气,化学方程式为CO(g)+H2O(g) ![]() H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入体积为2 L的密闭容器中,体系中各物质的浓度随时间的变化如图所示:
H2(g)+CO2(g)。一定条件下,将4 mol CO与2 mol H2O(g)充入体积为2 L的密闭容器中,体系中各物质的浓度随时间的变化如图所示:
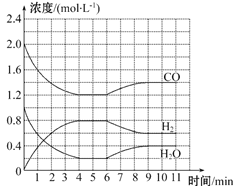
(1)在0~4 min时段,反应速率v(H2O)为_______mol·L-1·min-1,该条件下反应的平衡常数K为______(保留两位有效数字)。
(2)该反应到4 min时,CO的转化率为________。
(3)若6 min时改变的外部条件为升温,则该反应的ΔH________0(填“>”“=”或“<”),此时反应的平衡常数________(填“增大”“减小”或“不变”)。
(4)判断该反应达到化学平衡状态的依据是________。
a.混合气体的密度不变 b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆 d.断裂2 mol H—O键的同时生成1 mol H—H键
(5)若保持与4 min时相同的温度,向一容积可变的密闭容器中同时充入0.5 mol CO、1.5 mol H2O(g)、0.5 mol CO2和a mol H2,则当a=2.5时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为___________________________。
【答案】 0.2 2.7 40% < 减小 bc 正反应 a>4.05
【解析】(1)图象分析可知4min反应达到平衡状态,物质浓度为c(CO)=1.2mol/L,c(H2)=0.8mol/L,c(H2O)=0.2mol/L,则
CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 2 1 0 0
变化浓度(mol/L) 0.8 0.8 0.8 0.8
平衡浓度(mol/L) 1.2 0.2 0.8 0.8
在0~4min时段,反应速率v(H2O)=0.8mol/L÷4min=0.2mol/(Lmin),平衡常数K=0.8×0.8/1.2×0.2=2.7;
(2)该反应到4min时,CO的转化率=0.8/2×100%=40%;
(3)若6min时改变的外部条件为升温,图象可知氢气浓度减小,一氧化碳和水的浓度增大,说明平衡逆向进行,逆向为吸热反应,正反应为放热反应,则该反应的△H<0,此时平衡逆向进行,平衡常数减小;
(4)根据上述分析可知反应是气体体积不变的放热反应,则a.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,a错误;b.混合气体中c(CO)不变是平衡的标志,b正确;c.v(H2O)正=v(H2)逆,表示正逆反应速率相等,能证明反应达到平衡状态,c正确;d.断裂2molH-O键的同时生成1molH-H键,反应均是正向进行,不能说明正逆反应速率相同,d错误;答案选bc;
(5)若保持与4min时相同的温度,向一容积可变的密闭容器中同时充入0.5molCO、1.5molH2O(g)、0.5molCO2和amolH2,则当a=2.5时,浓度熵Q=2.5×0.5/0.5×1.5=1.7<K=2.7,说明反应正向进行;若要使上述反应开始时向逆反应进行,Q=a×0.5/0.5×1.5>2.7,则a的取值范围为a>4.05。