题目内容
【题目】(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据掌握的知识判断,下列有关实验操作的描述正确的是________(填下列各项序号)。
A.从试剂瓶中取出的任何药品,若有剩余均不能再放回原试剂瓶中
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢加入浓硫酸并不断搅拌
D.各放一张质量相同的滤纸于托盘天平的两托盘上,将NaOH固体放在左盘纸上称量
E.NaOH溶液不能保存在带有玻璃塞的试剂瓶中
F.将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“=”填写下列空白:
①用托盘天平称取10.4 g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取的氯化钠的质量________10.4 g。
②用容量瓶配制500 mL 0.1 mol·L-1NaOH溶液,定容时仰视刻度线,所得溶液的物质的量浓度________0.1 mol·L-1。
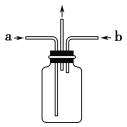
(3)实验时为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是_______,若氨气量较多,则瓶内会出现大量白烟,该白烟为___________,反应的方程式为___________(已知氮元素被氧化生成常见的单质)。
【答案】BE < < 氨气(NH3) 氯化铵(NH4Cl) 3Cl2+8NH3===6NH4Cl+N2
【解析】
(1)结合物质的性质、化学实验基本操作注意事项判断其正误;
(2)①左物右码分析解答;
②根据c=n÷V分析操作对溶质的物质的量或对溶液的体积的影响判断;
(3)根据氯气和氨气的密度大小分析,氯气和氨气反应生成氮气和氯化氢,氯化氢和氨气反应生成氯化铵,据此解答。
(1)A.对化学实验剩余药品,大多是不可以放回原瓶的,但是极少数例外,如金属钠切下一小块后可放回原瓶,故A错误;
B.碳酸钙或氢氧化钙均能与盐酸反应,可用稀盐酸洗涤盛放过石灰水的试剂瓶,故B正确;
C.量筒不能作反应容器,不能用来稀释浓硫酸,故C错误;
D.NaOH固体具有强腐蚀性,易潮解,应该在烧杯中称量,故D错误.
E.氢氧化钠能和玻璃中的二氧化硅反应,生成硅酸钠是矿物胶,可以粘结瓶口和瓶塞,因此NaOH溶液不能保存在带有玻璃塞的试剂瓶中,故E正确;
F.不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,故F错误;
故答案为:BE;
(2)①用托盘天平称取10.4 g氯化钠,若将砝码和氯化钠的位置放颠倒了,由左盘质量=右盘的质量+游码的质量可知药品质量=砝码质量-游码质量,即所称取的氯化钠的质量为9.6 g;
②若定容时仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低,故所得溶液浓度小于0.1mol/L;
(3)由于氯气密度大于氨气,则实验时为使氯气、氨气在如图所示装置中充分混合并反应,由于氨气的密度较小、氯气的密度较大,故在a口通入的气体是氨气。二者反应生成氮气和氯化氢,若氨气量较多,则氯化氢和氨气反应生成氯化铵,所以瓶内会出现大量白烟,反应的方程式为3Cl2+8NH3=6NH4Cl+N2。

 阅读快车系列答案
阅读快车系列答案