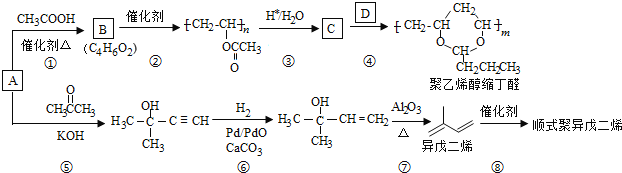
题目内容
【题目】H2O2在工业、农业、医药上都有广泛的用途.
(1)H2O2是二元弱酸,写出第一步的电离方程式__,第二步的电离平衡常数表达式Ka2=_________.
(2)许多物质都可以做H2O2分解的催化剂.一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化).下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是________.
①I - ②Fe3+ ③Cu2+ ④Fe2+
(3)H2O2是一种环境友好的强氧化剂.电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+等)制备硫酸镍的一种流程如下:
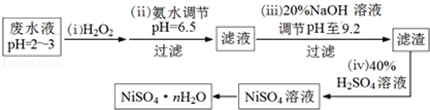
①第(ⅰ)步,加入H2O2反应的离子方程式_________________.
②为测定NiSO4nH2O的组成,进行如下实验:称取2.627g样品,配制成250.00mL溶液.准确量取配制的溶液25.00mL,用0.04000molL﹣1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA标准溶液25.00mL.则硫酸镍晶体的化学式为__________________.
【答案】 H2O2H++HO2﹣ 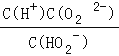 ①④ 2Fe2++H2O2+2H+=2Fe3++2H2O NiSO46H2O
①④ 2Fe2++H2O2+2H+=2Fe3++2H2O NiSO46H2O
【解析】(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2![]() H++HO2-;第二步电离为:HO2-
H++HO2-;第二步电离为:HO2-![]() O22+H+,所以电离平衡常数Ka2=
O22+H+,所以电离平衡常数Ka2=![]() 。(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I、Fe2+具有较强的还原性,故①④正确。(3)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2=2Fe3++2H2O;②根据方程式:Ni2++H2Y2-=NiY2-+2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O。
。(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I、Fe2+具有较强的还原性,故①④正确。(3)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2=2Fe3++2H2O;②根据方程式:Ni2++H2Y2-=NiY2-+2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O。

 阅读快车系列答案
阅读快车系列答案