题目内容
【题目】过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
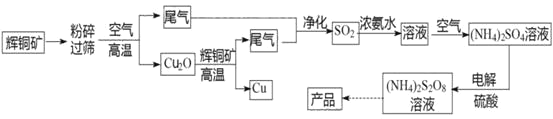
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________。在该反应中,n(氧化剂):n(还原剂)=________。
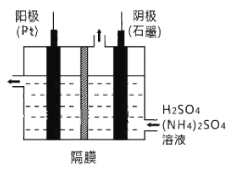
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________。当电路中转移2.5mol电子时,阴极产生________(填数值)mol________(填物质)。
(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________、________、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________。
【答案】增大固体与气体的接触面积,加快化学反应速率 Cu2S+2Cu2O=6Cu+SO2↑ 3:1 2SO42--2e-=S2O82- 1.25 H2 过滤 洗涤 2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+
【解析】
(1)矿石“粉碎”可增大固体与气体的接触面积,加快化学反应速率;
(2)根据Cu2S+2Cu2O![]() 6Cu+SO2↑化合价的变化判断氧化剂与还原剂及关系;
6Cu+SO2↑化合价的变化判断氧化剂与还原剂及关系;
(3)根据装置图电解时,阳极为SO42-电解生成S2O82-及转移电子数目进行计算;
(4)制取二硫酸铵晶体,采用蒸发浓缩、降温结晶、过滤、洗涤、干燥等操作;
(5)过二硫酸铵检验废水中的Cr3+超标时溶液会变成橙色。
(1)矿石“粉碎”可增大固体与气体的接触面积,加快化学反应速率;
(2)Cu2O和辉铜矿在高温下反应的化学方程式为:Cu2S+2Cu2O![]() 6Cu+SO2↑;在该反应中,Cu2S、Cu2O中Cu由+1价降低到0价,为氧化剂,n(氧化剂)=3mol,Cu2S中S化合价由-2升高到+4,为还原剂,n(还原剂)为1mol,n(氧化剂):n(还原剂)=3:1;
6Cu+SO2↑;在该反应中,Cu2S、Cu2O中Cu由+1价降低到0价,为氧化剂,n(氧化剂)=3mol,Cu2S中S化合价由-2升高到+4,为还原剂,n(还原剂)为1mol,n(氧化剂):n(还原剂)=3:1;
(3)工业上,常采用电解法制取(NH4)2S2O8,根据装置图电解时,阳极为SO42-电解生成S2O82-,其电极反应式为2SO42--2e-=S2O82-,当电路中转移![]() 电子时,阴极的电极反应式为2H++2e-=H2↑,产生1.25molH2;
电子时,阴极的电极反应式为2H++2e-=H2↑,产生1.25molH2;
(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、过滤、洗涤、干燥等操作;
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式2 Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+。

【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表![]() 不考虑生成N2O4)
不考虑生成N2O4)
0 | 10 | 20 | 30 | 40 | 50 | |
实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是( )
A.实验2比实验1的反应容器内压强减小
B.实验2比实验l使用了效率更高的催化剂
C.实验1比实验3的平衡常数大
D.实验2和实验3可判断该反应是放热反应