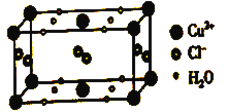
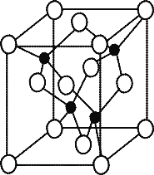
题目内容
【题目】下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法正确的是
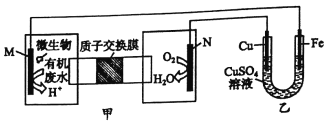
A. 电子的流动方向M→Fe→CuSO4溶液→Cu-N
B. M极电极反应式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 当N极消耗5.6LO2时,则铁极增重32g
D. 一段时间后,乙中CuSO4溶液浓度基本保持不变
【答案】D
【解析】根据题给信息知,甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应;乙部分是在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连。A.M是负极,N是正极,电子不能通过溶液,故A正确;B.H2N(CH2)2NH2在负极M上失电子发生氧化反应,生成但其、二氧化碳和水,电极反应式为H2N(CH2)2NH2+4H2O-16e-═2CO2↑+N2↑+16H+,故B错误;C.未注明是否为标准状况,无法计算5.6LO2的物质的量,故C错误;D.乙部分是在铁上镀铜,电解液浓度基本不变,所以乙中CuSO4溶液浓度基本保持不变,故D正确;故选D。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图:
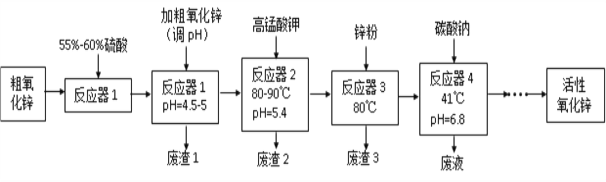
已知:
①pH=5.4时,KMnO4的还原产物为MnO2。
②以上实验条件下各种氢氧化物沉淀的pH情况如下表所示。
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
根据以上信息,回答下列问题:
(1)工艺过程中各步骤均用到的分离方法是_______________________________。
(2)“废渣1”的主要成分是______________________________________________。
(3)“反应器2”中两个氧化还原反应的离子方程式为_______________________________________________________________
(4) “反应器3”中加入锌粉的作用是________________________________。
(5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。