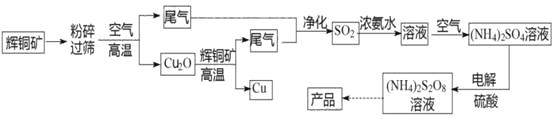
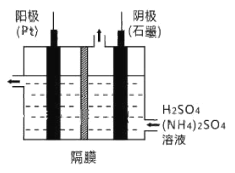
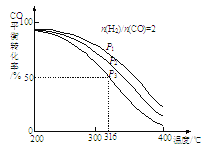
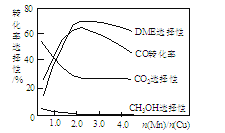
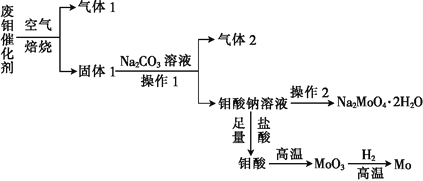
题目内容
【题目】下列有关说法正确的是
A.电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变
B.NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强
C.SO3(g)+H2O(l)=H2SO4(aq)在常温下能自发进行,则该反应的△H<0
D.0.1 mo1·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
【答案】C
【解析】
A.电解精炼铜时,阳极除了铜失去电子外,还有杂质失去电子,而阴极一定是铜离子得到电子,所以电解液CuSO4溶液的物质的量浓度减小,A错误;
B.NaClO溶液中通入少量CO2后生成次氯酸和碳酸钠,ClO-水解程度减小,溶液碱性降低,B错误;
C.SO3(g)+H2O(l)=H2SO4(aq)在常温下能自发进行,因为正反应熵变减小,则根据△G=△H-T·△S<0可知该反应的△H<0,C正确;
D.0.1 mo1·L-1CH3COOH溶液加水稀释后促进电离,醋酸根的物质的量增加,醋酸的物质的量减小,因此溶液中![]() 的值增大,D错误。
的值增大,D错误。
答案选C。

【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
选择如图所示装置设计实验制备亚氯酸钠晶体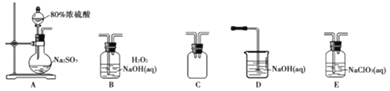
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)