题目内容
【题目】某化学兴趣小组探究氯与水反应的热效应及所得溶液氯元素含量,查阅大量资料并做下列实验探究验证
实验Ⅰ:在通风橱内向装有80mL蒸馏水的锥形瓶![]() 瓶口塞上棉花团
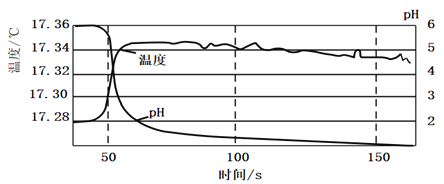
瓶口塞上棉花团![]() 中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:
中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:
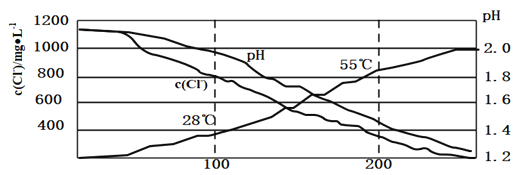
实验Ⅱ:对20mL饱和氯水加热,测出c(Cl—)、pH及温度变化如图2所示。
实验Ⅲ:采用莫尔法测定氯水中氯元素的含量。此法是以![]() 为指示剂,用
为指示剂,用![]() 标准溶液进行滴定。其实验步骤如下:
标准溶液进行滴定。其实验步骤如下:
①准确移取25.00ml氯水试样3份,分别置于锥形瓶中,再分别加入25.00ml水;
②向试样中加入足量的![]() 溶液;
溶液;
③除去过量的![]() ,冷却;
,冷却;
④调整溶液的pH,再加入![]()
![]() 溶液,在不断摇动下用
溶液,在不断摇动下用![]()
![]()
![]() 标准溶液滴定至溶液呈砖红色
标准溶液滴定至溶液呈砖红色![]()
![]() 砖红色
砖红色![]() ]
]
⑤重复上述实验,测得消耗![]() 标准溶液体积的平均值为vmL
标准溶液体积的平均值为vmL
回答下列问题:
(1)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。该反应的离子方程式为______;估算该离子反应的平衡常数______
(2)根据实验Ⅰ测定结果判断氯气与水的反应是______![]() 填“吸热反应”或“放热反应”
填“吸热反应”或“放热反应”![]() 理由是______
理由是______
(2)分析实验Ⅱ图,小组同学推测产生该结果的原因可能是多种反应造成的,下列叙述合理的是______
A.升温,氯气挥发导致c(Cl—)减小
B.对于![]() 和
和![]() 的反应,升温平衡逆向移动,c(Cl—)减小,pH减小
的反应,升温平衡逆向移动,c(Cl—)减小,pH减小
C.升温,促进次氯酸分解2HClO![]() 2HCl+O2↑
2HCl+O2↑
D.升温,可能发生3HClO![]() 2HCl+HClO3(强酸) ,使得pH减小
2HCl+HClO3(强酸) ,使得pH减小
(4)实验Ⅲ步骤3中加足量的![]() 溶液,目的是______
溶液,目的是______
(5)用![]() 标准溶液滴定氯离子达到化学计量点时,
标准溶液滴定氯离子达到化学计量点时,![]() ,若此时要求不生成
,若此时要求不生成![]() 沉淀,则
沉淀,则![]() 最大不能超过______
最大不能超过______![]() 已知:
已知:![]() ,
,![]()
(6)计算实验Ⅲ氯水中氯元素的含量,列出算式:______![]()
【答案】![]()
![]() 放热反应 随氯气通入,溶液温度升高 ACD 足量的过氧化氢可将氯气完全还原为氯离子
放热反应 随氯气通入,溶液温度升高 ACD 足量的过氧化氢可将氯气完全还原为氯离子 ![]()
![]()
【解析】
(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:![]() ,在1L水中可溶解
,在1L水中可溶解![]() 氯气,氯气浓度近似为
氯气,氯气浓度近似为![]() ,则可建立如下三段式:
,则可建立如下三段式:
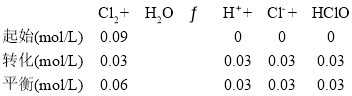
则平衡常数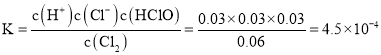 ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)由图可知,随氯气通入,发生反应使溶液温度升高,则正反应为放热反应,故答案为:放热;随氯气通入,溶液温度升高;
(3)A.升高温度、气体的溶解度减小,则导致![]() 减小,故A正确;
减小,故A正确;
B.为放热反应,升高温度平衡逆向移动,![]() 减小,而pH增大,故B错误;
减小,而pH增大,故B错误;
C.HClO不稳定,受热易分解,升温,促进次氯酸分解,故C正确;
D.升温,可能发生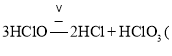 强酸
强酸![]() ,酸性增强,则pH减小,故D正确;故答案为:ACD;
,酸性增强,则pH减小,故D正确;故答案为:ACD;
(4)实验Ⅲ步骤3中加足量的![]() 溶液,目的是足量的过氧化氢可将氯气完全还原为氯离子,故答案为:足量的过氧化氢可将氯气完全还原为氯离子;
溶液,目的是足量的过氧化氢可将氯气完全还原为氯离子,故答案为:足量的过氧化氢可将氯气完全还原为氯离子;
(5)用![]() 标准溶液滴定氯离子达到化学计量点时,
标准溶液滴定氯离子达到化学计量点时,![]() ,不生成
,不生成![]() 沉淀,则
沉淀,则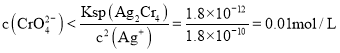 ,故答案为:
,故答案为:![]() ;
;
(6)由![]() 可知,实验Ⅲ氯水中氯元素的含量为
可知,实验Ⅲ氯水中氯元素的含量为![]() ,故答案为:
,故答案为:![]() 。
。