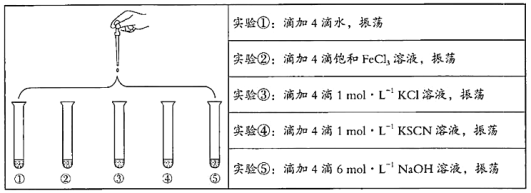
题目内容
【题目】钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金、建筑和交通等领域应用前景广阔。回答下列问题:
(1)三氟化钛可用于制取钛氟玻璃,基态 F 原子核外有_____个未成对电子,Ti 原子形成Ti3+时价层电子层排布式为_____。
(2)TiO2 的熔点为 1800℃,TiCl4 的熔点为-25℃,则 TiO2 的晶体类型为_____,TiCl4 熔点低的原因为_____。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
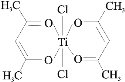
①钛的配位数为_____,该化合物中电负性最大元素是_____(填元素符号)。
②该配合物中不含有的化学键有_____(填字母标号)。
a.离子键 b.σ键 c.金属键 d.π键
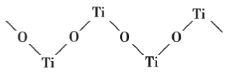
(4)已知 TiO2 与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_____,阳离子中 O 的杂化方式为_____,阴离子的空间构型为_____。
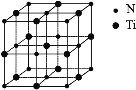
(5)氮化钛可以用于制作电池的材料,其晶胞如图,该晶胞的密度为ρ g·cm-3,与氮原子最近的且距离相等的钛原子有_____个,氮原子与钛原子最近的距离为_____cm。
【答案】1 3d1 原子晶体 TiCl4为分子晶体,分子间作用力弱 6 O ac ![]() sp3 正四面体 6
sp3 正四面体 6 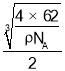
【解析】
(1)基态 F 原子核外有7个电子,1个未成对电子;Ti 原子外层电子排布式为:3d24s2,Ti 原子形成Ti3+时失去三个电子,价层电子层排布式为:3d1,故答案为:1;3d1;
(2)TiO2 的熔点为 1800℃,其熔点很高;TiCl4 的熔点为-25℃,其熔点较低,则 TiO2 的晶体类型为原子晶体,TiCl4为分子晶体,分子晶体的结构粒子为分子,分子间作用力较弱,因此,分子晶体的熔点较低,故答案为:原子晶体;TiCl4为分子晶体,分子间作用力弱;
(3)①根据图知,与Ti原子相连接的配位原子有6个,其配位数是6;元素的非金属性越强,其电负性越大。在该化合物中非金属性最强元素是O,因此,该化合物中电负性最大元素是O;
②Ti原子和氯原子、O原子之间存在配位键,C-H和C-C及C-O原子之间存在σ键,碳碳双键和碳氧双键中存在σ键和π键,不存在离子键和金属键,故选ac;
(4)根据结构图可知,Ti和O的比例为1:1,则阳离子化学式为![]() ,由结构图可知O含有2个σ键,含有2个孤电子对,则杂化方式为sp3杂化;阴离子SO42-的中心原子S的价层电子对数为
,由结构图可知O含有2个σ键,含有2个孤电子对,则杂化方式为sp3杂化;阴离子SO42-的中心原子S的价层电子对数为![]() ,则SO42-的空间构型为正四面体结构,故答案为:
,则SO42-的空间构型为正四面体结构,故答案为:![]() ;sp3;正四面体;
;sp3;正四面体;
(5)由晶胞示意图可知与氮原子最近的且距离相等的钛原子有6个;晶胞中Ti原子数为![]() ,N原子数为
,N原子数为![]() ,则晶胞质量为
,则晶胞质量为![]() ,则体积
,则体积![]() ,则氮原子与钛原子最近的距离晶胞边长的一半,即0.5
,则氮原子与钛原子最近的距离晶胞边长的一半,即0.5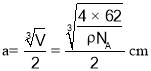 ,故答案为:6;
,故答案为:6; 。
。