题目内容
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是

A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
【答案】B
【解析】
试题分析:浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,可能发生反应为:2NaOH + CO2 = Na2CO3 + H2O、Na2CO3 + CO2 + H2O = 2NaHCO3,故所得溶液溶质可能为:①NaOH、Na2CO3,②Na2CO3,③Na2CO3、NaHCO3,④NaHCO3;再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,可能发生反应为:NaOH+ HCl = NaCl + H2O, Na2CO3 + HCl = NaHCO3 + NaCl,NaHCO3 + HCl = NaCl + CO2↑ + H2O,由图像可知A曲线前50ml不产生气体,后150ml,产生气体,故A溶液 溶质为③Na2CO3、NaHCO3,故A项错误;B曲线前100ml不产生气体,后100ml产生气体,可知该溶液为②Na2CO3溶液,则可知通入的CO2体积为0.1L×0.2mol/L×22.4L/mol×1000=448ml,故B项正确;由图象可知加入盐酸200ml后反应完毕,则原NaOH溶液的浓度为0.2L×0.2mol/L÷0.1L=0.4 mol/L,故C项错误;C曲线前150ml无气体产生,后50ml产生气体,可知溶液溶质为①NaOH、Na2CO3,可知C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=2:1,故D项错误;本题选B。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | SO2缓慢通入滴有酚酞的NaOH溶液中,溶液红色褪去 | SO2具有漂白性 |
B | 将充满NO2的密闭玻璃球浸泡在热水中,气体红棕色加深 | 2NO2(g) |
C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
D | 向2支均盛有2mL相同浓度Na3[Ag(S2O3)2]溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
【题目】二甲基砜是合成人体胶原蛋白的必要物质。实验室用二甲基硫醚为原料合成二甲基砜的新方法为:
反应 i:(CH3)2S+H2O2→(CH3)2SO+H2O
反应 ii: 。
二甲基硫醚(CH3)2S | 二甲基亚枫(CH3)2SO | 二甲基砜(CH3)2SO2 | |
密度 | 0.85 g·cm-3 | 1.10 g·cm-3 | —— |
熔点/沸点 | -83.2℃/37.5℃ | 18.4℃/189℃ | 111℃/238℃ |
溶解性 | 不溶于水 | 易溶于水、乙醇 | 易溶于水、乙醇 |
具体流程如下:
![]()
回答下列问题:
(1)反应装置如图所示,仪器 B 的名称是_____,其作用是_____。
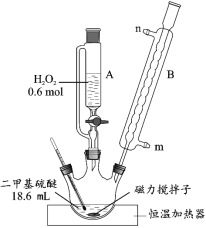
(2)第①步反应温度不高于 40 ℃的原因是_____;该步骤反应完全的现象是_____。
(3)第②步先将 A 中滴加剩余的 H2O2 全部加入三颈烧瓶中,然后加热发生反应 ii。该反应的化学方程式为_____。
(4)第③步的实验操作为_____、过滤、低温干燥,得到二甲基砜产品。
(5)二甲基砜传统的生产工艺是由 HNO3 氧化(CH3)2S 生成(CH3)2SO,然后用 NaOH 中和、精馏,制得精品(CH3)2SO,最后再经氧化制得(CH3)2SO2。该新方法与传统硝酸氧化法比的优点有_____(至少回答 2 点)。
(6)该实验中制得二甲基砜 19.176g。二甲基砜的产率为_____。