题目内容
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
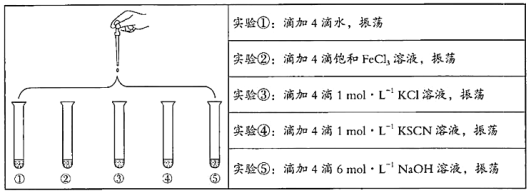
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
【答案】B
【解析】
实验①为对照组,控制反应溶液的总体积相同,在其它条件不变时,只改变影响平衡的一个条件,判断平衡的移动方向,则可得出该条件对平衡的影响,据此分析可得结论。
A.实验②与①对比,只改变了Fe3+浓度,故A说法正确;
B.FeCl3溶液和KSCN溶液反应的本质是Fe3++3SCN-![]() Fe(SCN)3,改变钾离子或氯离子的浓度对平衡没有影响,故B说法错误;
Fe(SCN)3,改变钾离子或氯离子的浓度对平衡没有影响,故B说法错误;
C.实验④与①对比,只改变的反应物SCN-的浓度,故C说法正确;
D.在原平衡体系中加入NaOH溶液,Fe3+与之反应生成Fe(OH)3沉淀,溶液中Fe3+的浓度减小,故D说法正确;
答案选B。

练习册系列答案
相关题目
【题目】如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上
没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是
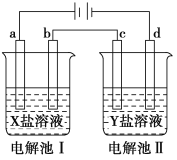
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
A. A B. B C. C D. D