题目内容
【题目】以下为配制250 mL 0.2 mol·L-1 Na2CO3溶液的示意图。
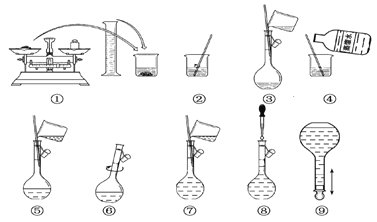
回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2 cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转并摇动多次
(2)①中称得Na2CO3________g。
(3)玻璃棒在②、③两步中的作用分别是________、________。
(4)若出现如下情况,所配溶液浓度偏低的有:________
A.某同学在第⑧步观察液面时仰视;
B.没有进行操作步骤④和⑤;
C.在第⑤步不慎有少量液体流到容量瓶外;
D.在步骤①中,药品放在右盘,砝码放在左盘(使用游码)。
【答案】BCD 5.3 搅拌 引流 ABCD
【解析】
(1)容量瓶在使用前必须查漏;容量瓶是比较精密的仪器,不能受热,故不能用于溶解固体和稀释溶液,也不能用作反应容器,据此分析;
(2)根据溶质的质量m=nM=cVM计算;
(3)溶解固体时搅拌是加速溶解,过滤时是引流作用;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析对所配溶液的浓度影响。
分析对所配溶液的浓度影响。
(1)A.使用容量瓶前应该检验是否漏水,故A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,否则会影响配制溶液的浓度,故B错误;
C.配制溶液时,如果试样是固体,应该在烧杯中溶解,当药品完全溶解后,恢复至室温,再把溶液小心转移到容量瓶中,并洗涤烧杯和玻璃棒2~3次,将洗涤液转移入容量瓶中,然后缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,不能把称好的固体用纸条倒入容量瓶中,故C错误;
D.配制溶液时,若试样是液体,应该在烧杯中溶解或稀释,恢复至室温,再把溶液小心倒入容量瓶中,并洗涤烧杯和玻璃棒2~3次,将洗涤液转移入容量瓶中,然后缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,不能把液体药品直接引流到容量瓶中,故D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故答案为BCD;
(2)0.2molL-1Na2CO3溶液250mL需要Na2CO3的质量为:0.25L×0.2mol/L×106g/mol=5.3g;
(3)玻璃棒在溶解固体时为了加速溶解,起搅拌作用,过滤时是起引流作用;
(4)A.某同学在第⑧步观察液面时仰视,溶液的体积偏大,所得溶液浓度偏低,故A符合题意;
B.操作步骤④和⑤是洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶,如果没有步骤④和⑤,则容量瓶内溶质物质的量偏低,所配溶液的浓度偏低,故B符合题意;
C.在第⑤步不慎有少量液体流到容量瓶外,则容量瓶内溶质物质的量偏低,所配溶液的浓度偏低,故C符合题意;
D.在步骤①中,药品放在右盘,砝码放在左盘(使用游码),则所称量的药品的质量偏小,浓度偏低,故D符合题意;
故答案为ABCD。

【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。