题目内容
2012年3月22日是第二十届“世界水日”,保护水资源,从我做起!
(1)C1O2和C12(还原产物都为Cl一)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,C1O2的消毒效率是C12的 倍。
(2)自来水厂常用高铁酸钠(Na2FeO4,强氧化剂)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理: 。
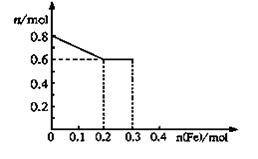
(3)某无色废水中可能含有Fe3+、A13+、Mg2+、Na+、NO3-、CO32一、SO42-离子中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关现象如图所示: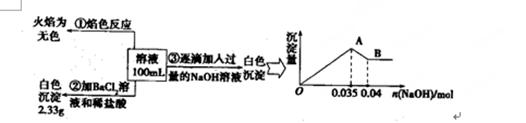
请根据上图回答下列问题:
①实验中需配制1.0 mol/L的NaOH溶液80 ml,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为 。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为 。
③试确定NO3-是否存在? (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-) (若不存在,此问不必作答)。
(1)2.5 (2)FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的 (3)①100ml容量瓶 ②Al(OH)3+OH-=AlO2-+2H2O
③存在;0.15mol/L
解析试题分析:(1)ClO2和Cl2的还原产物都为Cl-,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍;
(2)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的;
(3)①配制1.0mol/L的NaOH溶液100mL,根据实验步骤所需仪器:玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管、100mL容量瓶;故答案为:100mL容量瓶;
②实验③中A→B过程是Al(OH)3与OH-发生反应,其方程式为:Al(OH)3+OH-=AlO2-+2H2O;
③根据实验①确定无Na+,根据实验②确定有SO42-,根据实验③确定有Al3+无Fe2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、SO42-,已知硫酸钡沉淀为2.33g,则n(SO42-)=2.33g÷233g/mol=0.01mol, 根据图象可知与Al(OH)3的OH-为:n(OH-)=0.005mol,
Al(OH)3 +OH-=AlO2-+2H2O Fe2++2OH-=Fe(OH)2↓
n(Al3+ 0.005mol n(Fe2+) 0.035-3n(Al3+)
所以n(Al3+)=0.005mol,n(Fe2+)=0.01mol
因此溶液中Fe2+和Al3+所带正电荷与SO42-所带负电荷不相等,所以存在NO3-
设NO3-物质的量为nmol,根据电荷守恒得:3n(Al3+)+2n(Fe2+)=2n(SO42-)+n(NO3-)
即n(NO3-)=0.015mol,所以c(NO3-)═0.015mol÷0.1L=0.15mol/L。
考点:考查常见离子检验,现象的判断和有关计算

下列过程不涉及氧化还原反应的是
| A.燃放鞭炮 | B.氯化铵和熟石灰混合加热制氨气 |
| C.金属冶炼 | D.浓盐酸和二氧化锰混合加热制氯气 |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是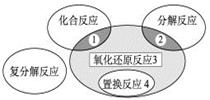
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O +CO2↑ Na2CO3+H2O +CO2↑ |
| C.Zn +H2SO4= ZnSO4 + H2↑ |
D.CuO+CO  Cu + CO2 Cu + CO2 |
下列对化学反应的认识中,错误的是( )
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |
 Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3