题目内容
(12分)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3- + 2Cl- + 4H+ = 2ClO2↑+ Cl2↑+ 2H2O。
(1)写出第二步反应的离子方程式 。
(2)工业生产时需在反应物中加少量Cl-,其作用是 。
(3)生产中会发生副反应ClO3- + Cl- + H+ - Cl2↑+ H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 。
(写出解题过程)
(1)CH3OH + 3Cl2 + H2O = 6Cl- + CO2 + 6H+ (2分)
(2)催化剂(2分) (3)1︰6.1(8分)
解析试题分析:根据题意得第一步反应的产物Cl2应与另一种反应物CH3OH反应,生成CO2与Cl-,故反应为CH3OH + 3Cl2 + H2O = 6Cl- + CO2 + 6H+ ;Cl-参与反应但反应前后没有变化,故为催化剂,起催化作用;(3)发生的反应方程式为①CH3OH + 6ClO3- + 6H+ = CO2↑+ 6ClO2↑+5H2O
②ClO3- + 5Cl- + 6H+ = 3Cl2↑+ 3H2O
假设反应后混合气体的物质的量为73mol,则n(Cl2)="3mol"
由反应①产物气体量的关系得n(CO2)=10mol n(ClO2)=60mol
则n(CH3OH)=10mol n(ClO3-)=60mol
由反应②得该反应的n(ClO3-)=1mol
所以n(CH3OH) :n(ClO3-)=10:(60+1)=1:6 .1
考点:考查氧化还原反应知识,涉及氧化还原反应方程式的书写、计算等内容。

Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物中n(NO2)∶n(NO)=1∶1时,下列说法正确的是 ( )
| A.产物中n[Cu(NO3)2]∶n[CuSO4]=1∶1 |
| B.参加反应的n(Cu2S)∶n(HNO3)=1∶5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.1 mol Cu2S参加反应时有8 mol电子转移 |
固体NH5属于离子晶体。它与水反应的化学方程式为:NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.与水反应时,水作氧化剂 | B.NH5中N元素的化合价为+5价 |
| C.1 mol NH5中含有5NA个N—H键 | D.与乙醇反应时,NH5被还原 |
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法正确的是
| A.该反应中Cl2作还原剂 |
| B.碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C.反应中每生成1 mol Na2H3IO6,转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2 : 1 |
已知5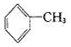 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为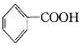 | B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
已知Iˉ、Fe2+、SO2、Clˉ、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Clˉ< Fe2+< H2O2< Iˉ< SO2。则下列反应不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42ˉ+4H+ |
| B.Cl2+SO2+2H2O=H2SO4+2HCl |
| C.H2O2+2H++ SO42ˉ=SO2↑+O2↑+2H2O |
| D.2I2+H2O2=2H2O+O2↑+4 Iˉ |
对下列事实的解释正确的是
| A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| C.向50mL18mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol |
| D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |