题目内容
(8分)钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。
完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____________________。
(3)在20.00mL的0.1mol/L VO2+溶液中,加入 0.195g锌粉,恰好完成反应,则还原产物可能是__________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+____________。
(1)V2O5 +K2SO3+2H2SO4→2VOSO4+K2SO4+2H2O
(写成离子方程式也给分V2O5 + SO32–+4H+→2VO2++ SO42–+2H2O )
(2) + 3H2O→Cl–+ 6VO2++6H+
+ 3H2O→Cl–+ 6VO2++6H+
(3)b
(4)Cl2+ SO32–+ H2O→2Cl–+ 2H++ SO42–
解析试题分析:(1)根据题意知,V2O5与稀硫酸、亚硫酸钾反应生成VOSO4、K2SO4和H2O,化学方程式为:V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O;(2)根据题意知,ClO3-与VO2+反应生成VO2+、Cl-,利用原子守恒、电荷守恒和化合价升降法配平该反应的离子方程式,并标出电子转移的数目和方向为: + 3H2O=Cl–+ 6VO2++6H+;(3)0.195g锌粉的物质的量的0.003mol,令V元素在还原产物中的化合价为a,根据电子守恒知:0.003×2=0.02L×0.1mol/L×(5-a),解得a=2,选b;(4)V2O5能和盐酸反应生成氯气和VO2+,故还原性Cl->VO2+,氯气可以将亚硫酸根氧化生成硫酸根、自身被还原为Cl-,可以说明还原性SO32->Cl-,反应离子方程式为:Cl2+SO32-+H2O=2Cl-+2H++SO42-。
+ 3H2O=Cl–+ 6VO2++6H+;(3)0.195g锌粉的物质的量的0.003mol,令V元素在还原产物中的化合价为a,根据电子守恒知:0.003×2=0.02L×0.1mol/L×(5-a),解得a=2,选b;(4)V2O5能和盐酸反应生成氯气和VO2+,故还原性Cl->VO2+,氯气可以将亚硫酸根氧化生成硫酸根、自身被还原为Cl-,可以说明还原性SO32->Cl-,反应离子方程式为:Cl2+SO32-+H2O=2Cl-+2H++SO42-。
考点:考查氧化还原反应方程式的书写与计算、还原性强弱的比较。

下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是
| A.纯碱 | B.烧碱 | C.硫酸 | D.硝酸 |
已知5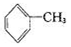 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为 | B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
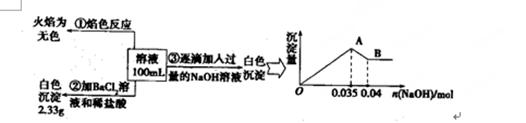

 CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。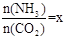 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。