题目内容
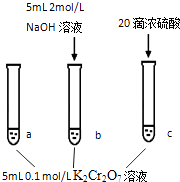
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度
【答案】C
【解析】解:A.反应中元素化合价没有变化,不属于氧化还原反应,故A错误;
B.试管b中溶液颜色不变的目的是使反应到达平衡,且可逆反应中反应物不能完全转化,故B错误;
C.加入氢氧化钠溶液,可能是增大氢氧根离子浓度使平衡正向移动,不能证明减小生成物浓度使平衡正向移动,故C正确;
D.增大氢离子浓度、温度升高均使平衡逆向移动,无法说明影响平衡的主要因素是温度,故D错误,
故选:C.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目