题目内容
【题目】有图所示装置,装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极. 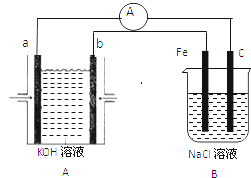
(1)b极反应式为 , a极反应式为 , C电极反应式为 .
(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 , 此时要恢复原溶液的浓度需加入(填化学式).
(3)若将装置B改为电解精炼铜,则粗铜作极,阴极反应为 .
【答案】
(1)2H2﹣4e﹣+4OH﹣=4H2O;O2+4e﹣+2H2O=4OH﹣;4Cl﹣﹣4e﹣=2Cl2↑
(2)14;HCl
(3)阳;Cu2++2e﹣=Cu
【解析】解:装置A是氢氧燃料电池,已知该装置工作时电子从b极流向Fe电极,则b为负极,a为正极,负极上氢气失电子生成水,正极上氧气得电子生成氢氧根离子,Fe为阴极,阴极上氢离子得电子生成氢气,C为阳极,阳极上氯离子失电子生成氯气,(1)b为负极,负极上氢气失电子生成水,其电极反应为:2H2﹣4e﹣+4OH﹣=4H2O;a为正极,正极上氧气得电子生成氢氧根离子,则正极的电机反为:O2+4e﹣+2H2O=4OH﹣;C为阳极,阳极上氯离子失电子生成氯气,其电极方程式为:4Cl﹣﹣4e﹣=2Cl2↑;
所以答案是:2H2﹣4e﹣+4OH﹣=4H2O;O2+4e﹣+2H2O=4OH﹣;4Cl﹣﹣4e﹣=2Cl2↑;(2)若装置B中溶液体积为100mL,假设反应前后溶液体积不变,当装置A中消耗0.05mol氢气时,则转移电子为0.1mol,装置B中溶液中消耗0.1mol氢离子,生成0.1mol氢氧根离子,所以氢氧根离子的浓度为1mol/L,则溶液的pH为14;电解方程式为:2H2O+2Cl﹣ ![]() H2↑+Cl2↑+2OH﹣ , 溶液中减少了Cl、H两种元素,所以要加HCl恢复原溶液的浓度;
H2↑+Cl2↑+2OH﹣ , 溶液中减少了Cl、H两种元素,所以要加HCl恢复原溶液的浓度;
所以答案是:14;HCl;(3)电解精炼时,粗铜作阳极,纯铜作阴极,阴极上铜离子得电子生成Cu,则阴极反应为Cu2++2e﹣=Cu;
所以答案是:阳;Cu2++2e﹣=Cu.

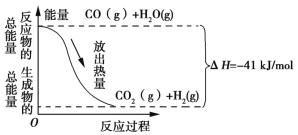
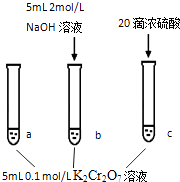
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度