题目内容
【题目】以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
A.对钢材“发蓝”(钝化)B.选用铬铁合金
C.外接电源负极D.连接锌块
【答案】D
【解析】
牺牲阳极的阴极保护法指的是原电池的负极金属易被腐蚀,而正极金属被保护的原理,为防止钢铁被腐蚀,应连接活泼性较强的金属,以此解答。
牺牲阳极的阴极保护法是原电池的负极金属易被腐蚀,而正极金属被保护的原理,是原电池原理的应用,利用被保护的金属做正极被保护选择,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,在电池内电路为阳极,称为牺牲阳极的阴极保护法,题目中选择锌做阳极,故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度
【题目】1000ml某无色待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、CO32﹣、HCO3﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):(已知:NH4++OH﹣(浓)=NH3↑+H2O)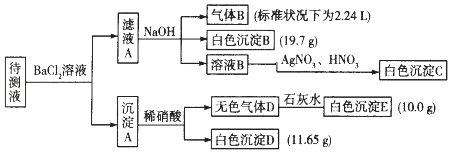
(1)原溶液中肯定存在的离子是(除Na+) , 肯定不存在的离子是 .
(2)写出生成白色沉淀B的离子方程式: . 写出沉淀A溶于稀硝酸的离子方程式: .
(3)将滤液A和沉淀A分开的操作是过滤,洗涤.洗涤的操作是 .