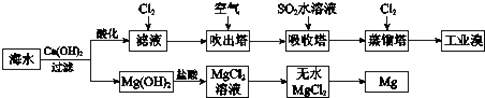
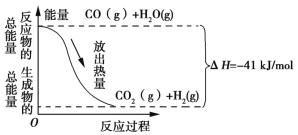
题目内容
【题目】在稀溶液中,强酸与强碱反应的中和热为57.3 kJ/mol。下列热化学方程式中正确的是
A.HNO3(aq)+KOH(aq)![]() H2O(l)+KNO3(aq) ΔH >57.3 kJ/mol
H2O(l)+KNO3(aq) ΔH >57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)![]() H2O(l)+NH4NO3(aq) ΔH <57.3 kJ/mol
H2O(l)+NH4NO3(aq) ΔH <57.3 kJ/mol
C.CH3COOH(aq)+KOH(aq)![]() H2O(l)+CH3COOK(aq) ΔH <57.3 kJ/mol
H2O(l)+CH3COOK(aq) ΔH <57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)![]() H2O(l)+CH3COONH4(aq) ΔH >57.3 kJ/mol
H2O(l)+CH3COONH4(aq) ΔH >57.3 kJ/mol
【答案】D
【解析】A项中ΔH=57.3 kJ/mol,A错;B、C两项中,NHH2O、CH3COOH为弱电解质,电离时需吸收热量,分别与强酸、强碱发生中和反应生成1 mol水时,放出的热量小于 57.3 kJ,故ΔH>57.3 kJ/mol,B、C错。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
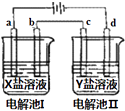
【题目】如图所示的电解池I和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )
选项 | X | Y |
A | AgNO3 | Cu(NO3)2 |
B | MgSO4 | CuSO4 |
C | FeSO4 | Al2(SO4)3 |
D | CuSO4 | AgNO3 |
A.A
B.B
C.C
D.D
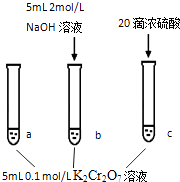
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度