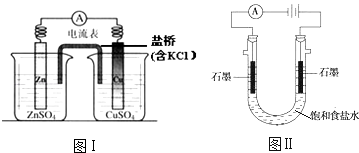
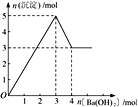
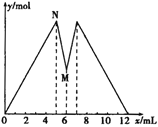
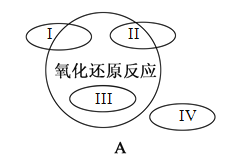
题目内容
【题目】用0.1molL﹣1NaOH溶液滴定0.1molL﹣1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL〕.继续加水至50mL,所得溶液的pH是( )
A.4
B.7.2
C.10
D.11.3
【答案】C
【解析】解:终点时不慎多加了1滴NaOH溶液,即0.05mL,继续加水至50mL,
反应后溶液中c(OH﹣)= ![]() ×0.1mol.L﹣1=10﹣4mol.L﹣1 ,
×0.1mol.L﹣1=10﹣4mol.L﹣1 ,
根据c(H+)c(OH﹣)=10﹣14 ,
则c(H+)=10﹣10mol/L,
pH=10,
故选C.
【考点精析】根据题目的已知条件,利用酸碱中和滴定的相关知识可以得到问题的答案,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

练习册系列答案
相关题目
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是( )
已知: | |
步骤: | 现象: |
A.该反应是一个氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72﹣完全反应
C.该实验不能证明减小生成物浓度,平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是温度