题目内容
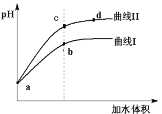
【题目】已知T ℃时两种弱酸的电离平衡常数如下表。将pH和体积均相同的两种酸溶液M、N分别稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是
弱酸 | HNO2 | CH3COOH |
电离平衡常数 | 5.0×10-4 | 1.7×10-5 |
A.曲线Ⅰ代表CH3COOH溶液
B.M、N两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.溶液中水的电离程度:b点<c点
D.从c点到d点,溶液中 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
【答案】B
【解析】
根据K可知,酸性HNO2> CH3COOH,加水稀释时HNO2的pH变化较大,则曲线I为CH3COOH,曲线II为HNO2。
A. 分析可知,曲线Ⅰ代表CH3COOH溶液,与题意不符,A不选;
B. M、N两溶液pH相同,CH3COOH酸性弱,含有的未电离的分子多,消耗NaOH多,则溶液中n(Na+)多于HNO2溶液的,符合题意,B选;
C. b、c两点溶液的pH越大,则溶液中水的电离程度越大,则水的电离程度:b点<c点,与题意不符,C不选;
D. 从c点到d点,溶液的温度未变, =
= 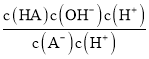 =
=![]() ,保持不变(其中HA、A-分别代表相应的酸和酸根离子),与题意不符,D不选;
,保持不变(其中HA、A-分别代表相应的酸和酸根离子),与题意不符,D不选;
答案为B。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
实验目的 | 试剂 | 试管中的物质 | |
A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯 ②甲苯 |
C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯 ②己烯 |
D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液 ②碳酸溶液 |
A.AB.BC.CD.D
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4=K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
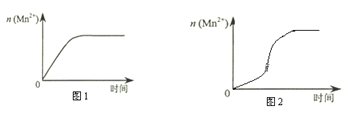
该小组同学提出的假设是___________________________________________________。
(3)测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________。
Ⅱ、下列操作会导致测定结果偏低的是______。
A.锥形瓶用待测草酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
Ⅲ、计算:血液中含钙离子的浓度为______mol/L。