题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1 L 0.1 mol·L-1 AlCl3溶液中离子总数为0.4NA
B.精炼铜,若阳极重量减轻32 g,则电路中一定通过NA个电子
C.N2(g) + 3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1 若放出46.2 kJ热量,则反应消耗N2分子数为0.5NA
2NH3(g) ΔH=-92.4 kJ·mol-1 若放出46.2 kJ热量,则反应消耗N2分子数为0.5NA
D.1 mol FeCl3完全水解生成的Fe(OH)3胶粒数目小于NA
【答案】CD
【解析】
A. 1 L 0.1 mol·L-1 AlCl3溶液中,Al3++3H2OAl(OH)3+3H+,离子总数大于0.4NA,A错误;
B. 精炼铜,阳极失电子的可能为Zn、Fe、Cu,若阳极重量减轻32 g,则电路中通过的电子数不能确定,B错误;
C. N2(g) + 3H2(g) NH3(g) ΔH=-92.4 kJ·mol-1 若放出46.2 kJ热量,则反应消耗N2分子数为0.5NA,C正确;
D. 1 mol FeCl3完全水解生成的Fe(OH)3胶粒数目与n(Fe3+)略小,则胶粒数目小于NA,D正确;
答案为CD。

练习册系列答案
相关题目
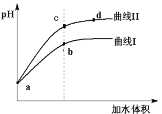
【题目】已知T ℃时两种弱酸的电离平衡常数如下表。将pH和体积均相同的两种酸溶液M、N分别稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是
弱酸 | HNO2 | CH3COOH |
电离平衡常数 | 5.0×10-4 | 1.7×10-5 |
A.曲线Ⅰ代表CH3COOH溶液
B.M、N两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.溶液中水的电离程度:b点<c点
D.从c点到d点,溶液中 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)




