��Ŀ����
����Ŀ��N��Si�Ǻϳ����ͷǽ������ϵ�������ҪԪ�ء���ش�:
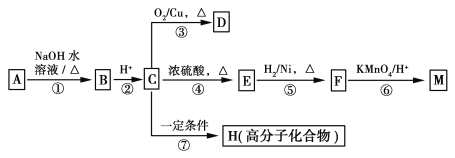
��1����̬Siԭ�ӵļ۲�����Ų�ͼΪ ��Siԭ�ӿ��γɶ����⻯�����Si2H6��Siԭ�ӵļ۲���Ӷ���ĿΪ ��
��2��ClO3-��ClO4-��Cl������ �����Oԭ�� ����ɼ�������������ṹ�ֱ�Ϊ �� ��
��3��N��Si�γɵ�ԭ�Ӿ����У�Nԭ�ӵ���λ��Ϊ ��
��4��NaN3����Ϊ������ȫ���ҵ���������ɫ��ӦΪ��ɫ�����������Ԫ������ɫ��Ӧ����ԭ��Ϊ ��N3-����������������Ŀ֮��Ϊ ��B��F��N����Ԫ��ͬ���ڣ����ֻ�̬ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ ����Ԫ�ط��ű�ʾ��
��5��SiO2�ľ�������ʯ����ͼ��ʾ�����ƣ����Կ���Siԭ�����Cԭ�Ӻ��������ɼ���Siԭ�Ӽ����1��Oԭ���γɡ���
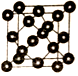
����������С�Ļ�����_____��ԭ�ӡ�
���������ܶ�Ϊ��g��cm3������٤������ΪNA�����������������Siԭ�Ӻ�֮��ľ���Ϊ____pm(�ô���ʽ��ʾ)��
���𰸡�
��1��![]() 4
4
��2��sp3 2p ������ ����������
��3��3
��4�����Ӵӽϸ��ܼ��ļ���̬ԾǨ���ϵ��ܼ��ļ���̬������̬ʱ���Թ����ʽ�ͷ����� 1��1 F��N��B
��5��V�Σ������Ρ������ξ����֣�
��6����12 ��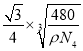 ��1010
��1010
��������
���������
��1����̬Siԭ�ӵļ۲�����Ų�ʽΪ3s23p2���ʵ����Ų�ͼΪ![]() ��Si2H6�ṹ��C2H6���ƣ�������Siԭ�ӵļ۲���Ӷ���ĿΪ4��
��Si2H6�ṹ��C2H6���ƣ�������Siԭ�ӵļ۲���Ӷ���ĿΪ4��
��2��ClO3-��ClO4-��Cl�۵��Ӷ�������4�ԣ�������sp3�����Oԭ�ӵ�2p����ɼ�������������ṹ�ֱ�Ϊ�����Ρ����������Ρ�
��3��Nԭ��ֻ���γ�3�����ۼ�����N��Si�γɵ�ԭ�Ӿ����У�Nԭ�ӵ���λ��Ϊ3��
��4����ɫ��Ӧ��ʵ���ǵ��Ӵӽϸ��ܼ��ļ���̬ԾǨ���ϵ��ܼ��ļ���̬������̬ʱ���Թ����ʽ�ͷ����������ݵȵ�����ԭ����N3-��CO2��Ϊ�ȵ����壬��N3-�ЦҼ��ͦм�����Ŀ֮��Ϊ1:1��ͬ����Ԫ�صĵ�һ����������仯Ϊ��С��������B��F�� N��һ�������ɴ�С��˳��ΪF��N��B��
��5����SiO2��������С�Ļ�����12��ԭ�ӡ�
�ھ��������������Siԭ�Ӻ�֮��ľ���Ϊ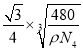 ��1010pm��
��1010pm��

 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�