题目内容
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
甲同学设计实验的目的是 , 烧杯 (填字母)中的反应最剧烈。
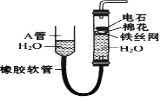
(Ⅱ)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置以验证氮、碳、硅元素的非金属性强弱。
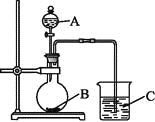
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:A: ;B: ; C: 。
(2)写出烧杯中发生反应的离子方程式:
(3)该装置存在着某个缺陷,改进的方法是
【答案】(Ⅰ)验证锂、钠、钾的活动性(或同一主族,从上到下元素的金属性逐渐增强),c ;
(Ⅱ)(1)HNO3、 CaCO3、Na2SiO3(或K2SiO3) ;(2)CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;(3)在B、C 之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶。
【解析】试题分析:(I)Li、Na、K属于同一主族,根据元素周期律,同一主族同上到下,原子半径增大,金属性增强,因此实验目的是验证Li、Na、K的活动性或探究同一主族金属性的递变的性质,钾的活动性最强,反应最剧烈;(II)A是强酸,常温下可与Cu反应,则A为HNO3,验证三种元素的非金属性,可以通过最高价氧化物对应水化物的酸性强弱进行比较,酸性越强,非金属性越强,因为B是块状固体,因此B为CaCO3,C为Na2SiO3;(2)利用酸性强的制取酸性弱的,其离子反应方程式为:2H++CO32-=CO2↑+H2O,CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;(3)因为硝酸挥发,会对后面的实验产生干扰,必须除去,因此在B、C 之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶。