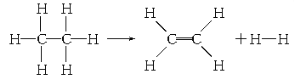
题目内容
【题目】燃料电池将是21世纪获得电能的重要途径。近几年开发的丁烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
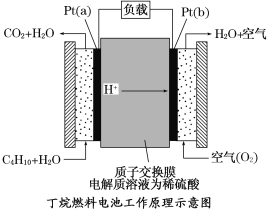
请回答下列问题:
(1)Pt(b)电极是电池的________极,电极反应式为_____________________________;Pt(a)电极发生________反应(填“氧化”或“还原”),电极反应式为____________。
(2)若电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为_____________;Pt(a)电极的电极反应式为_____________________________________________________________。
(3)如果该电池工作时电路中通过1.2 mol电子,则消耗掉O2在标准状况下的体积为________L。
【答案】
(1) 正,O2+4e-+4H+═2H2O;氧化,CH4-8e-+2H2O═CO2+8H+;
(2) O2+2H2O+4e-==4OH-,C4H10+34OH--26e-====4CO32-+22H2O ;
(3) 6.72L
【解析】
试题分析:(1)燃料电池中通氧气的一极发生还原反应为电池的正极,图上可以看出是酸性燃料电池,电极反应是为O2+4e-+4H+═2H2O,加燃料的一极发生氧化反应,为电池的负极,电极反应式为:CH4-8e-+2H2O═CO2+8H+,答案为:正,O2+4e-+4H+═2H2O;氧化,CH4-8e-+2H2O═CO2+8H+;(2)电解质溶液改为KOH溶液,Pt(b)电极的电极反应式为O2+2H2O+4e-==4OH-,Pt(a)电极的电极反应式为:C4H10+34OH--26e-====4CO32-+22H2O,答案为:O2+2H2O+4e-==4OH-,C4H10+34OH--26e-====4CO32-+22H2O ;(3)每反应掉1mol氧气,转移4mol电子,所以转移1.2mol电子,反应了的氧气的物质的量为:0.3mol,标准状况下的体积为6.72L,答案为:6.72L.

【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
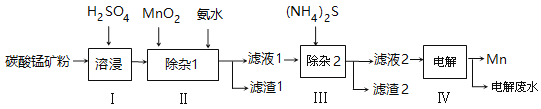
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该滤渣1所涉及的离子方程式为 、 。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+):c(Ni2+)= 。
(5)将质量为akg的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)