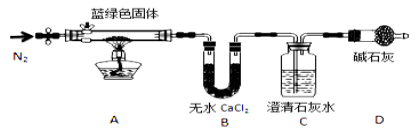
题目内容
【题目】捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
在海洋碳循环中,通过右图所示的途径固碳。

①写出钙化作用的离子方程式:______ ______________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O。 用18O标记光合作用的化学方程式如下,将其补充完整。
__________+__________![]() (CH2O)x+x18O2+ xH2O)
(CH2O)x+x18O2+ xH2O)
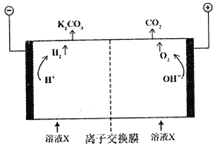
(2)工业上常用高浓度K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,并将CO2富集,其装置如下图。在阳极区发生的反应包括_________和H++HCO3-=H2O+CO2↑。简述CO32-在阴极区再生的原理:______________。
(3)将上述富集的CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径。合成气用干制备甲醇的反应为:2H2(g) +CO (g) ![]() CH3OH(g) △H=-90.l kJ/mol
CH3OH(g) △H=-90.l kJ/mol
在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表。

根据上表信息填空(填写“>”“< ”或“=”):
2c1_________c3;②|x|+|y|___________90.1;
③2p2_________p3;④α1+α2_________1
【答案】(1)①2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O(2分)②xCO2 ![]() (2分)
(2分)
(2)4OH- -4e- =2H2O+O2↑(2分)HCO3-存在电离平衡:HCO3-![]() H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生(或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-)(3分)
H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生(或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-)(3分)
(3)①<(1分) ②=(1分) ③>(1分) ④ =(1分)
【解析】
试题分析:(1)①反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O;
②光合作用产生的氧气来源于水,即水中的氧原子采用示踪法标记为18O,依据元素守恒配平应需要CO2和H218O。
(2)根据装置图分析,与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气,电极反应为4OH--4e-=2H2O+O2↑;HCO3-存在电离平衡:HCO3-![]() H++CO32-,阴极H+放电浓度减小,平衡右移,所以CO32-在阴极再生。
H++CO32-,阴极H+放电浓度减小,平衡右移,所以CO32-在阴极再生。
(3)①根据等效平衡思想,2mol氢气和1molCO完全反应生成1molCH3OH,加入2mol甲醇相当于增大压强,平衡正向移动,则2c1<c3 ;②甲投入2mol氢气和1molCO,乙中投入1 mol甲醇,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为90.1kJ,则|x|+|y|=90.1;③丙容器反应物投入量2mol甲醇,是乙的二倍,若平衡不移动,丙中压强为乙的二倍,由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2 > p3;④甲容器和乙容器是达到等效平衡状态,甲正向进行,乙逆向进行,则α1+α2=1。