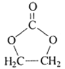
题目内容
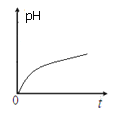
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。常温条件下反应时,溶液pH 随时间变化的曲线如图所示。下列判断错误的是
A.该反应的氧化剂是ClO-
B.该反应中有两种离子生成
C.该反应生成1mol氧化产物时,转移的电子为6 mol
D.参加反应的氧化剂与还原剂的物质的量之比为2 : 3
【答案】D
【解析】
试题分析:由图象分析可知,pH值随反应进行逐渐增大,ClO-应是反应物,氯元素化合价降低,是氧化剂,具有还原性的NH4+为反应物,由氮元素守恒可知N2是生成物,结合电子守恒、电荷守恒及原子守恒可得此反应的离子方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+。A.根据上述分析,该反应的氧化剂是ClO-,A项正确;B.该反应中有Cl-和H+两种离子生成,B项正确;C.由离子方程式可知,N元素化合价由-3价升高到0价,则该反应生成1mol氧化产物时,转移的电子为6 mol,C项正确;D.由方程式可知氧化剂和还原剂的物质的量之比为3:2,D项错误;答案选D。

【题目】下图是元素周期表的一部分,用表中①~⑨的元素符号或物质化学式回答问题:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素⑥的原子的核外电子数为_______,原子的L层电子数是K层2倍的元素为
_______(填元素符号);
(2)化学性质最不活泼的元素原子的原子结构示意图为____________;
(3)①~⑧中,元素原子半径最大的是________(填元素符号),这些元素的最高价氧化物对应的水化物中,酸性最强的酸是________(填化学式);
(4)请写出元素⑤的过氧化物的电子式______________;
(5)用电子式表示元素②的氢化物的形成过程________________________________。