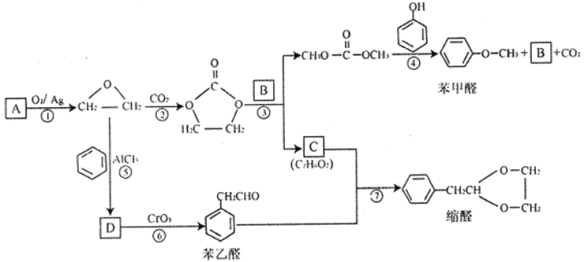
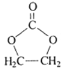
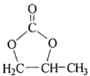
题目内容
【题目】对于1LH2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol·L-1,则理论上最多能溶解铜的物质的量为
A. 0.80mol 0.72mol B. 0.45mol C. 0.40mol
【答案】B
【解析】试题分析:铜不与硫酸反应,但能提供氢离子,硝酸与铜反应,生成硝酸铜,硝酸根离子与硫酸提供的氢离子可以继续反应,反应离子方程式如下:3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,硝酸根离子的浓度与氢离子的浓度比为1:4时,溶解的铜最多,设硫酸的物质的量为xmol,硝酸的物质的量为ymol,则x+y=1.2,y:(2x+y)=1:4,解得x=0.72mol,y=0.48mol,设参加反应的铜的最大物质的量是z,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2
z 0.48
![]() ;解得z=0.72mol,即理论上最多能溶解铜的物质的量为0.72mol;故选B。
;解得z=0.72mol,即理论上最多能溶解铜的物质的量为0.72mol;故选B。

【题目】下图是元素周期表的一部分,用表中①~⑨的元素符号或物质化学式回答问题:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素⑥的原子的核外电子数为_______,原子的L层电子数是K层2倍的元素为
_______(填元素符号);
(2)化学性质最不活泼的元素原子的原子结构示意图为____________;
(3)①~⑧中,元素原子半径最大的是________(填元素符号),这些元素的最高价氧化物对应的水化物中,酸性最强的酸是________(填化学式);
(4)请写出元素⑤的过氧化物的电子式______________;
(5)用电子式表示元素②的氢化物的形成过程________________________________。
【题目】下表是元素周期表的一部分,按要求填空(均填元素符号或化学式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在这些元素中,最活泼的非金属元素是______(填元素符号);元素的最高价氧化物对应水化物中,碱性最强的是______(填化学式)。
(3)④的单质和②的单质在点燃条件下生成物的电子式是_______;⑨的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(4)⑥与⑨形成的化合物和水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________________。
(5)元素①的气态氢化物与其最高价氧化物的水化物反应的化学方程式_________________。
(6)⑨的单质与⑩的最高价氧化物的水化物反应的离子方程式为___________________