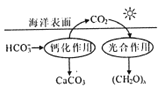
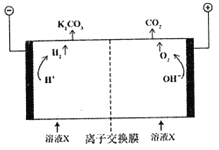
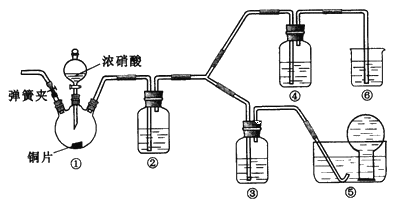
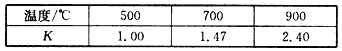
题目内容
【题目】铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,所得溶液加入Ba(NO3)2有白色沉淀生成。写出辉铜矿与高锰酸钾反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)=2 mol/L,c(H2SO4)=4 mol/L的废酸混合液100 mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 。
(3)现有一块含有铜绿〔Cu2(OH)2CO3〕的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。
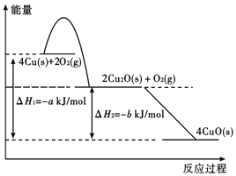
①固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。
②上述铜片中铜的生锈率为 (金属生锈率=![]() )。(结果保留到整数)
)。(结果保留到整数)
(4)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS)。
①硫化铜与氧气在淋滤作用下生成硫酸铜等,该过程的化学方程式为 。②写出渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式 ,请用简短的语言解释该反应发生的原理
【答案】(1)Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O(2)75g
(3)①2Cu(s)+1/2O2(g)=Cu2O(s)△H=-![]() kJ/mol②34%
kJ/mol②34%
(4)①CuS+2O2![]() CuSO4②Cu2++ZnS=CuS+Zn2+在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生)。
CuSO4②Cu2++ZnS=CuS+Zn2+在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生)。
【解析】
试题分析:(1)为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,所得溶液加入Ba(NO3)2有白色沉淀生成,这说明反应中有硫酸根生成,则辉铜矿与高锰酸钾反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O。
(2)含有c(HNO3)=2 mol/L,c(H2SO4)=4 mol/L的废酸混合液100 mL中氢离子的物质的量是1mol,硝酸根是0.2mol,则根据方程式3Cu+2NO32-+8H+=3Cu2++4H2O+2NO↑可知反应氢离子过量,0.2mol硝酸根能氧化0.3mol铜,所以最多生成0.3mol硫酸铜,则最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为0.3mol×250g/mol=75g。
(3)①根据图形可知固态铜与氧气反应生成1 mol固态氧化亚铜时放出的热量是![]() kJ,所以该反应的热化学方程式为2Cu(s)+1/2O2(g)=Cu2O(s)△H=-
kJ,所以该反应的热化学方程式为2Cu(s)+1/2O2(g)=Cu2O(s)△H=-![]() kJ/mol。
kJ/mol。
②现有一块含有铜绿〔Cu2(OH)2CO3〕的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同,这说明反应后生成的氧化铜与反应前固体的质量相等。假设混合物中铜的物质的量是xmol,铜绿的物质的量是ymol,则64x+222y=(x+2y)×80,解得x:y=31:8,则上述铜片中铜的生锈率为![]() 。
。
(4)①硫化铜与氧气在淋滤作用下生成硫酸铜等,该反应的化学方程式为CuS+2O2 ![]() CuSO4。②在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物,所以硫酸铜能与氯化锌反应生成硫化铜沉淀,则渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2++ZnS=CuS+Zn2+。
CuSO4。②在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物,所以硫酸铜能与氯化锌反应生成硫化铜沉淀,则渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2++ZnS=CuS+Zn2+。

【题目】下表是元素周期表的一部分,按要求填空(均填元素符号或化学式):
周期 族 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ |
(1)⑧位于元素周期表中第_______周期第_______ 族。
(2)在这些元素中,最活泼的非金属元素是______(填元素符号);元素的最高价氧化物对应水化物中,碱性最强的是______(填化学式)。
(3)④的单质和②的单质在点燃条件下生成物的电子式是_______;⑨的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(4)⑥与⑨形成的化合物和水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________________。
(5)元素①的气态氢化物与其最高价氧化物的水化物反应的化学方程式_________________。
(6)⑨的单质与⑩的最高价氧化物的水化物反应的离子方程式为___________________