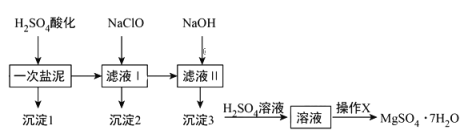
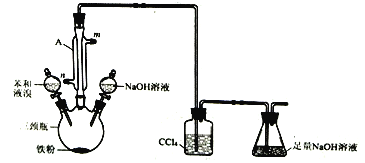
题目内容
【题目】将一定质量的KI和KCl固体混合物溶于水形成1000mL溶液,K+浓度为0.5mol·L-1,若向其中通入足量的Cl2,完全反应后将所得溶液蒸干,灼烧得到固体残留物比原固体混合物质量减少18.3g。
试计算:
(1)原固体混合物中KI的质量?___
(2)固体残留物中含有什么物质?___其物质的量是多少?___
【答案】33.2g KCl 0.5mol
【解析】
(1)若向KI和KCl固体混合物中通入足量的Cl2,KI与Cl2完全反应,生成KCl和I2,将所得溶液蒸干、灼烧,I2升华,得到固体残留物为KCl,可利用差量法,求出KI的质量;
(2)由上面分析可知,固体残留物为KCl,按K+守恒,可确定其物质的量。
若向KI和KCl固体混合物中通入足量的Cl2,KI与Cl2完全反应,生成KCl和I2,将所得溶液蒸干、灼烧,I2升华,得到固体残留物为KCl,可利用差量法,求出KI的质量。
设KI的质量为x
2KI+Cl2=KCl+I2 m
2×166g 2×74.5g 2×91.5g
x 18.3g
![]()
x= 33.2g 答案为:33.2g;
(2)由上面分析可知,固体残留物为KCl,按K+守恒,可确定其物质的量。
n(KCl)=1L×0.5mol·L-1=0.5mol。答案为:KCl;0.5mol。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目