��Ŀ����
����Ŀ����ͼ��ʾ���ס���Ϊ������������ء��Իش�

��1���ҳ���Fe���缫��ӦʽΪ___________�������ҳ��е���������̪��Һ����ʼ���һ��ʱ�䣬����������_________ɫ��
��2���׳���Ϊ�õ��ԭ������ͭ(�����ͭ������Ǿ��ȵģ��ұ�����úͲ����õijɷ־�����)��װ�ã���A�缫����Ϊ_____�����缫��ӦʽΪ____________���������Һ������______��ͨ��һ��ʱ���A������12.8g����׳���Һԭ���ʵ�Ũ��______(���������С���������䡱����ȷ����)���ҳ�C(ʯī)���ų������ڱ�״���µ����Ϊ________������ʱ���ҳ�ʣ����ҺΪ25�棬���Ϊ400 mL������Һ��pH��_______��
���𰸡�2H++2e-�TH2�� �� �� Cu2++2e-�TCu CuSO4 ��С 4.48L 14
��������
(1)����װ��ͼ���ҳ��к͵�Դ�������ӵ�C�缫Ϊ������FeΪ��������Һ�е������ӵõ����ӷ�����ԭ��Ӧ������������Һ������������Ũ������
(2)���ݵ�⾫��ԭ������ͭ����������ͭ����������ͭ���ӵĵ������Һ�����ݵ缫��Ӧ��ϵ����غ����ų��������������Ũ�ȣ��Ӷ�������Һ��pH��
(1)����װ��ͼ���ҳ��к͵�Դ�������ӵ�C�缫Ϊ������FeΪ��������Һ�е������ӵõ����ӷ�����ԭ��Ӧ���������������ķ�ӦʽΪ��2H++2e-�TH2������Һ������������Ũ������̪��죬�ʴ�Ϊ��2H++2e-�TH2�����죻
(2)�׳����õ��ԭ������ͭ����ͭ����������ͭ���������ú�ͭ���ӵĵ����Ϊ�������Һ���׳���AΪ������BΪ����������A�缫����Ϊ��ͭ���缫��ӦΪ��Cu2++2e-�TCu��B�缫Ϊ��ͭ��Cu-2e-�TCu2+���������Һ����Ϊ����ͭ��Һ��ͨ��һ��ʱ��׳��������ϴ�ͭ�е�����п�����Ƚ���ʧ���ӣ���Һ��ͭ���ӵõ���������ͭ��������Һ��ԭ���ʵ�Ũ�ȼ�С��A������12.8gΪͭ�����ʵ���=![]() =0.2mol��ת�Ƶ������ʵ���Ϊ0.4mol���ҳ���C�缫Ϊ��������Һ��������ʧ�������������������缫��ӦΪ2Cl--2e-�TCl2���������缫��Ӧ��2H++2e-�TH2������ط�ӦΪ2NaCl+2H2O
=0.2mol��ת�Ƶ������ʵ���Ϊ0.4mol���ҳ���C�缫Ϊ��������Һ��������ʧ�������������������缫��ӦΪ2Cl--2e-�TCl2���������缫��Ӧ��2H++2e-�TH2������ط�ӦΪ2NaCl+2H2O![]() 2NaOH+H2��+Cl2�����ݵ����غ㣬�����������ʵ���0.2mol����Ӧ�����������ʵ���Ϊ0.4mol����״�������=0.2mol��22.4L/mol=4.48L�����������Ӽ��ٺ�����������������ͬ����Һ������������Ũ��=
2NaOH+H2��+Cl2�����ݵ����غ㣬�����������ʵ���0.2mol����Ӧ�����������ʵ���Ϊ0.4mol����״�������=0.2mol��22.4L/mol=4.48L�����������Ӽ��ٺ�����������������ͬ����Һ������������Ũ��=![]() =1mol/L������pH=14���ʴ�Ϊ������Cu2++2e-�TCu��CuSO4����С��4.48L��14��
=1mol/L������pH=14���ʴ�Ϊ������Cu2++2e-�TCu��CuSO4����С��4.48L��14��

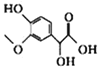
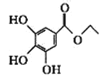
����Ŀ����֪�л���X��Y��Z�����ƺͽṹ��ʽ���±�������˵������ȷ����
X | Y | Z | |
���� | 3-������-4-�ǻ������� | ûʳ�������� | ������ |
�ṹ��ʽ |
|
|
|
A.X��Y��Z������NaOH��Һ��Ӧ
B.X��Y��Ϊͬ���칹�壬X��Z��Ϊͬϵ��
C.����X�����ƣ����Ʋ��Z������Ϊ3��5-��������-4-�ǻ�������
D.�Ʋ��ûʳ����ķ���ʽΪC7H6O5