题目内容
16.(1)由Zn-Cu-硫酸溶液组成的原电池,工作一段时间后,锌片的质量减少了6.5g.回答下列问题:①上述原电池的正极是:Cu,电极反应式:2H++2e-=H2↑.
②若将电解质溶液改为硫酸铜溶液,负极是:Zn,负极电极反应式:Zn-2e-=Zn2+;正极电极反应式:Cu2++2e-═Cu.当电池输出相同的电量时,电池两极的质量差为12.9g.
(2)由A、B、C、D四种金属按下表中装置进行实验.
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极的电极反应式是:A-2e-═A2+.
②装置乙中正极的电极反应式是:Cu2++2e-═Cu.
③装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
分析 (1)①活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的阳离子得电子;
②若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极;根据转移电子相等计算生成氢气的体积,根据转移电子相同计算阴极上生成铜的质量,两个电极的差为减少的锌的质量与析出铜质量的和;
(2)甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;
丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,
作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C.
解答 解:(1)①活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为:Cu;2H++2e-=H2↑;
②若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;正极上铜离子得电子生成Cu,电极反应式为:Cu2++2e-═Cu;电解硫酸铜溶液时,根据转移电子相等得析出铜的质量=$\frac{6.5g}{65g/mol}$=6.4g,两个电极的差为减少的锌的质量与析出铜质量的和,所以两个电极的质量差=6.5g+6.4g=12.9g;
故答案为:Zn;Zn-2e-=Zn2+;Cu2++2e-═Cu;12.9g;
(2)①该装置中,二价金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A-2e-═A2+,故答案为:A-2e-═A2+;
②乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-═Cu,故答案为:Cu2++2e-═Cu;
③丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应而作正极,D作负极,正极上氢离子逐渐析出而导致氢离子浓度逐渐减小,则溶液的pH逐渐增大,
故答案为:变大;
④通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,故答案为:D>A>B>C.
点评 本题考查原电池的工作原理,根据原电池电极上得失电子来判断正负极,侧重于基础知识的考查,题目难度不大,注意两极电极反应转移的电子数目相等.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
| A. | 催化剂能够改变反应的反应热 | |
| B. | 催化剂能够改变反应物的活化分子百分数 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过升高反应的活化能来加快反应速率 |

| A. | 在Ag催化下与O2反应时,①、③键断裂 | B. | 分子间脱水时,①②键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②、④键断裂 | D. | 与醋酸、浓硫酸共热时,②键断裂 |
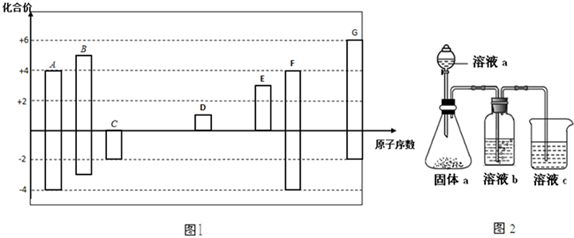
| A. | 两种元素原子的电子层上全部都是s电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子 | |
| D. | M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子 |
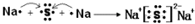 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.
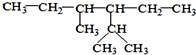 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷.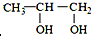 <
< 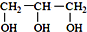 (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同) <
<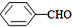
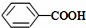 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)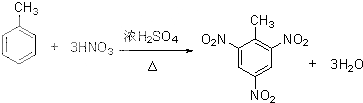 ;
;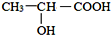 )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: .
.