题目内容
13.化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数.称取一定质量样品,置于坩锅中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩锅中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(2)实验中,需加热至恒重的目的是:保证NaHCO3分解完全
(3)试验中确定加热至恒重的方法是:两次称量坩锅的质量之差不超过0.1g
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果偏小(填“偏大”、“偏小”或“不变”)
分析 该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3=Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸汽H2O的量或残留的固体的量推算出小苏打样品中纯碱的质量分数.该方案根据加热后残渣的质量来求解,自然要加热至恒重,以保证NaHCO3全部分解.
(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(2)加热恒重保证碳酸氢钠完全分解;
(3)加热恒重是两次称量坩锅的质量之差不超过0.1g;
(4)加热过程中晶体迸溅出来,而造成加热前后固体的质量差偏大,碳酸钠质量增大,使碳酸钠测量结果偏小.
解答 解:(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,
故答案为:保证NaHCO3分解完全;
(3)试验中确定加热至恒重的方法是,加热恒重是两次称量坩锅的质量之差不超过0.1g,
故答案为:两次称量坩锅的质量之差不超过0.1g;
(4)若加热过程中坩埚内有晶体迸溅出来,测定碳酸氢钠质量会增大,得到碳酸钠测得的结果偏小,
故答案为:偏小.
点评 本题考查混合物中物质含量的测定,把握实验操作时的注意事项,分析误差时从导致加热前后的质量差进行判断,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
3.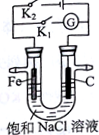 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| B. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48L气体 |
4.化学与人类生活密切相关,下列说法正确的是( )
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 能将工业酒精兑水后饮用,因为其中含有甲醇,它具有醇香味 |
1.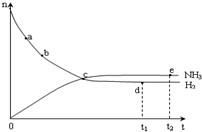 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |
8.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 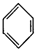 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$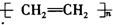 |
17.下列变化过程需要吸收能量的是( )
| A. | 氢气球发生爆炸 | B. | 向污染的河水中投放生石灰 | ||
| C. | 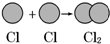 | D. | 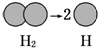 |
18.下列微粒结构示意图错误的是( )
| A. | 14C: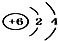 | B. | 16O: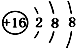 | C. | Li+: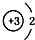 | D. | H-: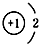 |
 .
. .
. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.