题目内容
6.T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.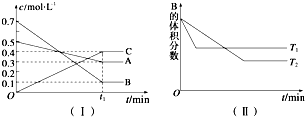
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g),正反应为放热(填“吸热”或“放热”)反应.
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有C(填字母序号).
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度.
分析 (1)随反应进行,A、B的物质的量浓度减小,为反应物,C的物质的量浓度增大,为生成物,最终A、B的浓度不变化,且不为0,属于可逆反应,利用浓度变化量之比等于化学计量数之比确定化学计量数,据此书写;由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明生成温度平衡向逆反应方向移动,据此判断该反应是吸热还是放热反应;
(2)该反应为放热反应,根据压强、温度、稀有气体对反应A+3B?2C的影响进行判断.
解答 解:(1)随反应进行,A、B的物质的量浓度减小,为反应物,C的物质的量浓度增大,为生成物,最终A、B的浓度不变化,且不为0,属于可逆反应,A、B、C的化学计量数之比=(0.5-0.3):(0.7-01):0.4=1:3:2,故反应方程式为:A(g)+3B(g)?2C(g);由图(Ⅱ)可知T1>T2,升高温度B的体积分数增大,说明升高温度平衡向逆反应方向移动,正反应为放热反应,
故答案为:A(g)+3B(g)?2C(g);放热;
(2)A.保持其他条件不变,增大压强,平衡向正反应方向移动,故A错误;
B 保持容器总体积不变,通入少量稀有气体,各组分的浓度不变,平衡不发生移动,故B错误;
C.该反应为放热反应,升高温度平衡向着向逆反应方向移动,故C正确;
故答案为:C.
点评 本题考查化学平衡图象问题,题目难度中等,解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键.

练习册系列答案
相关题目
1.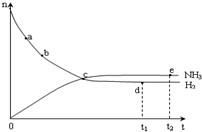 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |
17.下列变化过程需要吸收能量的是( )
| A. | 氢气球发生爆炸 | B. | 向污染的河水中投放生石灰 | ||
| C. |  | D. |  |
11.现有由两种可溶性化合物配成的混合溶液,且浓度均为0.1mol•L-1,其中阳离子可能是Fe2+、Al3+、Fe3+、H+,阴离子可能是NO3-、CO32-、I-、Cl-.若向溶液中加少量盐酸,则溶液变成黄色,且有气体生成.若不计水电离产生的少量离子,则下列说法一定正确的是:( )
| A. | 向溶液中加少量盐酸时,生成的气体可能含有CO2 | |
| B. | 原溶液中一定含有NO3-、Fe2+,一定不含Fe3+、H+、CO32- | |
| C. | 原溶液中一定含有的离子为NO3-,可能含有Fe2+、I- | |
| D. | 若原溶液中逐滴加入NaOH溶液,沉淀的量先增加后减少 |
18.下列微粒结构示意图错误的是( )
| A. | 14C: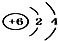 | B. | 16O: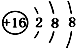 | C. | Li+: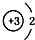 | D. | H-: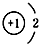 |
15.在下列关于新型有机高分子材料的说法中,不正确的是( )
| A. | 高分子分离膜应用于食品工业中,可用来浓缩天然果汁、乳制品加工、酿造业等 | |
| B. | 复合材料一般是以一种材料做基体,另一种材料作为增强剂 | |
| C. | 合成高分子材料制成的人工器官一般都受到人体的排斥,难以达到生物相容的程度 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
16.下列物质的分类合理的是( )
| A. | 氧化物:CuO、NO、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 碱性氧化物:Na2O、CaO、Al2O3、Na2O2 | |
| D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
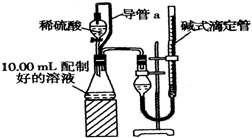 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
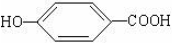
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液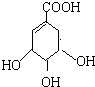 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图: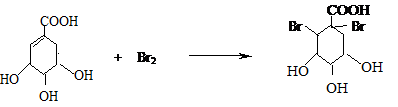 .
.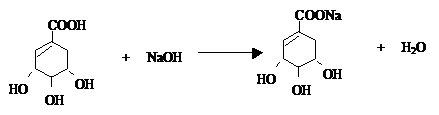 .
. ),其反应类型消去反应.
),其反应类型消去反应.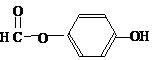 或
或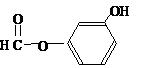 或
或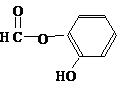 .
.