题目内容
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空)。
(2)DA2分子的VSEPR模型是___________。
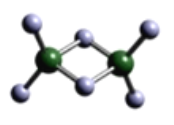
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。
②[C(OH)4]-中存在的化学键有________。
(4)B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
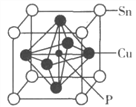
(5)D与E形成化合物晶体的晶胞如下图所示:
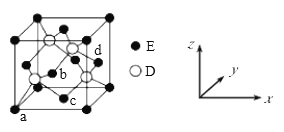
①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
【答案】Mg平面三角形分子sp3极性共价键、配位键Al3+比Mg2+电荷多,半径小4(1,![]() ,
,![]() )
)![]() ×1010
×1010
【解析】
A、D同主族且有两种常见化合物DA2和DA3,A为O元素,D为S元素;工业上电解熔融C2A3制取单质C,C为Al元素;B的原子序数在A与C之间,B最外层只有2个电子,其余各层全充满,B为Mg元素;E最外层只有2个电子,其余各层全充满,E位于元素周期表的ds区,E为Zn元素。
(1)第一电离能:Mg>Al。
(2)用价层电子对互斥理论判断DA2的VSEPR模型。
(3)①Al2Cl6加热时易升华,Al2Cl6属于分子晶体,Al形成4个σ键,Al上没有孤电子对,Al为sp3杂化。
②[Al(OH)4]-中含配位键和极性共价键。
(4)Al3+所带电荷数大于Mg2+,Al3+的半径小于Mg2+,AlF3的晶格能大于MgF2。
(5)①用“均摊法”和晶胞结构确定E的配位数。
②根据坐标系和晶胞中位置分析。
③用“均摊法”确定晶胞中所含D、E的个数,确定晶体的化学式,由密度计算1mol晶体的体积,继而计算晶胞的体积和晶胞的边长,2个D之间的距离是面对角线的一半。
A、D同主族且有两种常见化合物DA2和DA3,A为O元素,D为S元素;工业上电解熔融C2A3制取单质C,C为Al元素;B的原子序数在A与C之间,B最外层只有2个电子,其余各层全充满,B为Mg元素;E最外层只有2个电子,其余各层全充满,E位于元素周期表的ds区,E为Zn元素。
(1)B、C分别是Mg、Al,Al的价电子排布式为3s23p1,Mg的价电子排布式为3s2,Mg的3s全充满较稳定,第一电离能:Mg>Al,第一电离能较大的是Mg。答案为:Mg
(2)DA2为SO2,SO2中中心原子S上的孤电子对数为![]() ×(6-2×2)=1,S的σ键电子对数为2,S的价层电子对数为1+2=3,SO2的VSEPR模型是平面三角形。答案为:平面三角形
×(6-2×2)=1,S的σ键电子对数为2,S的价层电子对数为1+2=3,SO2的VSEPR模型是平面三角形。答案为:平面三角形
(3)①Al2Cl6加热时易升华,Al2Cl6属于分子晶体。根据Al2Cl6的结构示意图,Al形成4个σ键,Al上没有孤电子对,Al为sp3杂化。答案为:分子 sp3
②[Al(OH)4]-中Al3+与OH-之间为配位键,OH-内O与H之间为极性共价键,[Al(OH)4]-中含配位键和极性共价键。答案为:极性共价键、配位键
(4)Al3+所带电荷数大于Mg2+,Al3+的半径小于Mg2+,AlF3的晶格能大于MgF2。答案为:Al3+比Mg2+电荷多,半径小
(5)①用“均摊法”,晶胞中含S(D):4个,含Zn(E):8×![]() +6×
+6×![]() =4个,D与E的个数比为1:1,D的配位数为4,则E的配位数为4。答案为:4
=4个,D与E的个数比为1:1,D的配位数为4,则E的配位数为4。答案为:4
②原子的坐标参数:a(0,0,0);b(1/2,0,1/2);c(1/2,1/2,0),b位于前面的面心,c位于下底面的面心,d位于右侧面的面心,d原子的坐标参数为(1,![]() ,
,![]() )。答案为:(1,
)。答案为:(1,![]() ,
,![]() )
)
③用“均摊法”,晶胞中含S(D):4个,含Zn(E):8×![]() +6×
+6×![]() =4个,D与E的个数比为1:1,晶体的化学式为ZnS,1molZnS的质量为97g,1mol晶体的体积为
=4个,D与E的个数比为1:1,晶体的化学式为ZnS,1molZnS的质量为97g,1mol晶体的体积为![]() cm3;1个晶胞的体积为
cm3;1个晶胞的体积为![]() cm3,晶胞的边长为
cm3,晶胞的边长为![]() cm,两个D原子之间的距离为面对角线的一半,两个D原子之间的距离为
cm,两个D原子之间的距离为面对角线的一半,两个D原子之间的距离为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm。答案为:
×1010pm。答案为:![]() ×
×![]() ×1010
×1010

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
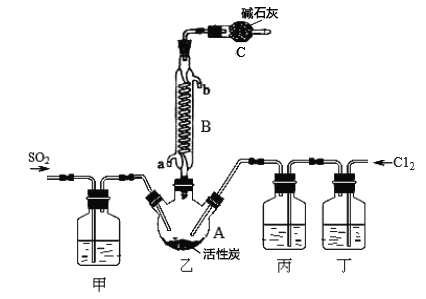
(1)写出浓盐酸和氯酸钾反应制取Cl2的离子方程式_________________。
(2)丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。