题目内容
【题目】实验室可用如图装置(启普发生器)制取氢气,欲使得到氢气的速率加快,下列措施可行的是
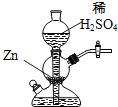
A. 将稀硫酸改为浓硫酸
B. 向稀硫酸中加入少量![]() 固体
固体
C. 向稀硫酸中加入![]() 溶液
溶液
D. 给装置中发生反应的部分加热
【答案】B
【解析】
根据外界条件对化学反应速率的影响分析,同时注意浓度变化、酸性条件下NO3-的强氧化性对化学反应的影响;启普发生器不能加热。
A项,将稀硫酸改为浓硫酸,Zn与浓硫酸反应生成SO2气体;
B项,向稀硫酸中加入少量CuSO4固体,Zn与CuSO4反应置换出Cu,置换出的Cu覆盖在Zn的表面,与稀硫酸构成原电池,使产生H2的速率加快;
C项,向稀硫酸中加入AgNO3溶液,会生成微溶物硫酸银覆盖在锌表面从而阻止锌与酸反应,而且Zn与H+、NO3-发生氧化还原反应生成Zn2+、NO和H2O;
D项,启普发生器适用于块状固体与液体常温下制备气体的发生装置,启普发生器不能加热;
能使得到H2的速率加快的可行措施是B项,答案选B。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____I-+____IO3—+____H+ =____I2+____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______,上述操作正确的顺序是:_______(填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所消耗的KI的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____mg/kg。
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 某溶液中加入盐酸酸化的 | 白色沉淀 | 溶液中一定含有 |
B | 用激光笔照射鸡蛋白溶液 | 有丁达尔效应 | 鸡蛋白溶液属于胶体 |
C | 某气体通入酸性 | 紫色褪去 | 该气体一定是 |
D | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无 |
A. A B. B C. C D. D
【题目】如下表是元素周期表的短周期,请根据表中的位置,按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用元素符号填空:在这十种元素中,化学性质最稳定的是_____,通常情况下化合价只有负价而无正价的是______,原子半径最小的是_______,原子半径最大的主族元素是_________。
(2)用化学式填空:在这十种元素中,最高价氧化物的水化物碱性最强的是______,酸性最强是________,呈两性的是_________。
(3)①和②形成的最简单的化合物的结构式是_____________。
(4)元素③的气态氢化物的电子式是________________。
(5)③可以形成多种氧化物,其中一种是红棕色气体,试用化学方程式说明该气体不宜采用排水法收集的原因__________________________。