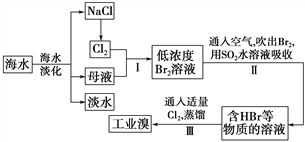
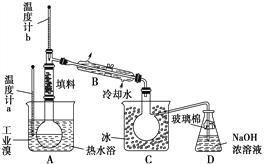
题目内容
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
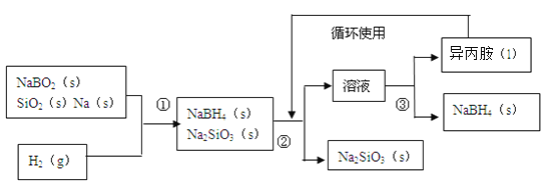
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:□NaBO2+□SiO2+□Na+□H2=□NaBH4+□Na2SiO3 ______________
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101kPa下,已知每消耗3.8克NaBH4(s)放热21.6kJ,该反应的热化学方程式是_______。
【答案】除去反应器中的水蒸气和空气 煤油 镊子 滤纸 1、2、4、2、1、2 过滤 蒸馏 NaBH4(s)+2H2O(l) = NaBO2(s)+4H2(g) △H=-216kJ/mol
【解析】
(1)由于NaBH4常温下能与水反应,且Na比较活泼,在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,其目的是除去反应器中的水蒸气和空气,避免影响反应;常温下Na易与空气中O2、H2O等反应,故少量金属钠保存在煤油里,以隔绝空气;实验室取用少量金属钠需要用到的实验用品有镊子(用镊子夹取钠块),滤纸(滤纸吸干表面的煤油),玻璃片和小刀等;
(2)根据氧化还原反应原理,得失电子总数相等,结合原子守恒可以配平此反应为:NaBO2+2SiO2+4Na+2H2=NaBH4+2Na2SiO3;
(3)从流程图中可以看出第②步分离的是固体和液体混合物,所以选用过滤的方法;第③步分离(NaBH4)并回收溶剂,只能先将溶剂蒸发再冷凝回收,即蒸馏的方法分离;
(4)n(NaBH4)=3.8g÷38g/mol=0.1mol,每消耗3.8克NaBH4(s)放热21.6kJ,则消耗1molNaBH4放热216kJ,故热化学方程式为:NaBH4(s)+2H2O(l) = NaBO2(s)+4H2(g) △H=-216kJ/mol。

【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
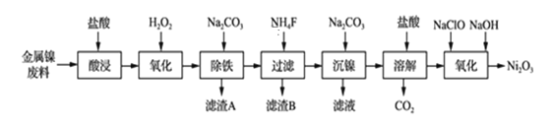
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________等。
(2)加入H2O2的目的是____________,所发生的离子方程式为____________________。
(3)“除铁”时,控制溶液pH的范围为_____________________。
(4)滤渣B的主要成分的化学式为___________________,滤液中的阳离子有________。
(5)“氧化”生成Ni2O3的离子方程式为________________。